El sistema inmunitario tiene como función principal la búsqueda de antígenos (proteínas erróneas o sus fragmentos) para su destrucción y la de los organismos que los sintetizan. La función primordial del sistema inmunitario es discriminar «lo propio» de lo «no propio».
Como es bien sabido, las dos estirpes fundamentales del sistema inmunitario son los linfocitos B y T, que, cuando se activan, aumentan su tamaño y pasan a denominarse células B y T respectivamente.
Las células B son capaces por sí solas de llevar a cabo el reconocimiento de los antígenos interaccionando con ellos directamente.
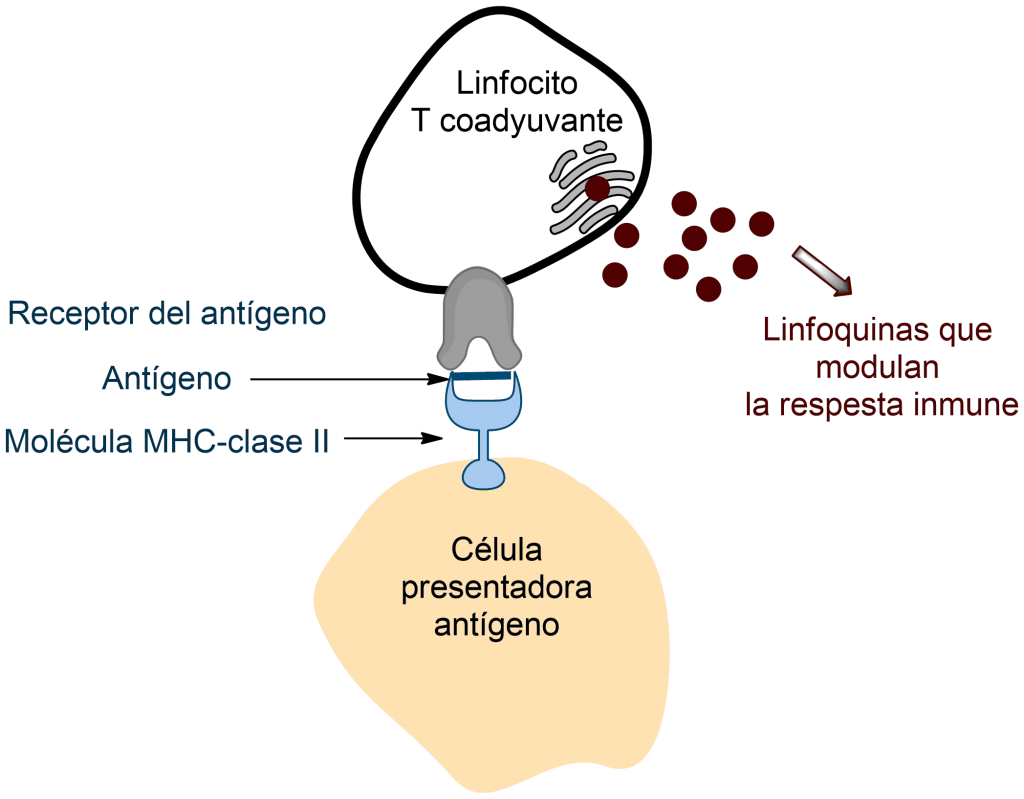
Por el contrario las células T son «ciegas». Solo reconocen a los antígenos si otras células se los presentan de manera adecuada.
Para que la reacción inmunitaria tenga lugar, los antígenos han ser presentados a las células T; y no de cualquier manera, sino asociados a determinadas proteínas celulares que forman parte del denominado complejo mayor de histocompatibilidad. El antígeno (más precisamente sus fragmentos a los que llamamos determinantes antigénicos) y las proteínas del complejo mayor de histocompatibilidad forman un constructo que activa a las células T. Según el tipo de proteínas del complejo mayor de histocompatibilidad a las que se asocie el determinante antigénico, las células T actuarán como coadyuvantes (estimulando la diferenciación de las células B) o como citotóxicas (destruyendo las células diana directamente).
Mientras las células B reconocen a los antígenos por su estructura terciaria (el plegamiento espacial de su estructura), las células T reconocen a los antígenos por su estructura primaria, esto es, su secuencia de aminoácidos.
El procesamiento de los antígenos previo a su presentación al sistema inmune se halla vinculado a los mecanismos de síntesis y reciclaje de las proteínas, y su transporte a través de distintas estructuras sub-celulares.
Las «células presentadoras de antígenos» son los macrófagos, las células dendríticas, los propios linfocitos B, y cualquier célula del organismo que exprese en su membrana determinantes antigénicos asociados a proteínas del complejo mayor de histocompatibilidad. Los fragmentos del antígeno (determinantes antigénicos) suelen ser péptidos de entre 10 y 20 aminoácidos.
Todas las células corporales exponen en su membrana externa un conjunto de moléculas proteicas pertenecientes al «Complejo Mayor de Histocompatibilidad» (MHC, por acrónimo en inglés). Ante la presencia de un antígeno (una molécula foránea o fragmentos de la misma), se forma un constructo «antígeno-MHC». La célula queda así «marcada», bien para su destrucción por linfocitos T citotóxicos, o para la activación de un clon de linfocitos B con el efecto dinamizador de las células T coadyuvantes. La naturaleza del antígeno condiciona el tipo de respuesta inmunitaria. Un antígeno foráneo (generalmente bacteriano) estimula la respuesta mediada por los linfocitos B; en cambio un antígeno proveniente de una célula renegada (tumoral) o sintetizada por la célula tras una infección vírica, desencadena una respuesta por células T citotóxicas.
Como se ha escrito antes, el tipo de procesamiento del antígeno determina el tipo de respuesta. Así, ante un antígeno foráneo la célula lo capta y procesa (hidroliza parcialmente) en los endosomas (estructuras sub-celulares). Los fragmentos de la proteína antigénica (secuencia de entre 10 y 20 aminoácidos) se expresan en la membrana junto a proteínas del complejo mayor de histocompatibilidad clase I. Se activan los linfocitos T coadyuvantes que liberan citoquinas que estimulan la diferenciación y activación de los linfocitos B. En cambio, cuando la proteína deriva de una célula renegada (tumoral o infectada por virus), el procesamiento transcurre en el citosol (fracción soluble del citoplasma). Los péptidos resultantes se exponen en la membrana asociados a proteínas del complejo mayor de histocompatibilidad clase II. Como resultado se activan los linfocitos T citotóxicos. Así pues, la selectividad de las proteínas del complejo mayor de histocompatibilidad (clase I o clase II) determina el tipo de respuesta inmunitaria: activación de células T coadyuvantes (cuando el antígeno es presentado junto a las proteínas clase I del complejo mayor de histocompatibilidad); y activación de las células T citotóxicas (si el antígeno es presentado por proteínas de la clase II del complejo mayor de histocompatibilidad).
Una estirpe fundamental de células inmunitarias son los macrófagos. Se desplazan por los tejidos fagocitando cualquier desecho metabólico, incluidos los antígenos. Tras el procesamiento intracelular de los antígenos (fragmentación en péptidos de menor peso molecular), los macrófagos exponen en su superficie el antígeno (o los fragmentos del mismo) asociado a las proteínas del complejo mayor de histocompatibilidad clase I. Los macrófagos se comportan, pues, como «células presentadoras de antígenos». En su nueva condición viajan hasta los ganglios linfáticos, donde interaccionan con una estirpe de linfocitos que comienzan a comportarse como coadyuvantes (T-helper). Coadyuvan estimulando la diferenciación de los linfocitos B, mediante la secreción de citoquinas (linfoquinas).
Así pues, el reconocimiento del constructo «antígeno-MHC» es la etapa decisiva en el desencadenamiento de la respuesta inmunitaria «mediada por células», para distinguirla de la inmunidad humoral.
La identificación y aislamiento de las proteínas del Complejo Mayor de Histocompatibilidad se convirtió en una prioridad en el área de la investigación en inmunología. Su descubrimiento vino del campo de los trasplantes de órganos.
George D. Snell y Peter A. Gorer describieron durante la década de 1930 un locus (posición genética) en el cromosoma 17 de ratones de laboratorio que era fundamental para la aceptación o rechazo de órganos trasplantados entre distintas cepas de roedores. Lo denominaron H2 (H, de histocompatibilidad).
En la década de 1950 Jean Dausset describió un locus genético similar en el hombre. El trabajo hizo merecedor a Jean Dausset del Premio Nobel de Fisiología y Medicina en el año 1980, ex aequo Baruj Benacerraf y George D. Snell. Enseguida se evidenció que el locus H2 (murino y humano) contenía muchos genes codificadores de lo que se dio entonces por llamar « antígenos de trasplante», esto es, moléculas que se expresan en la superficie celular y son reconocidas por el sistema inmunitario como «propias». Para el conjunto de proteínas codificadas por estos genes de histocompatibilidad se acuñó el sintagma Complejo Mayor de Histocompatibilidad. Resultaban críticos para la aceptación o rechazo de órganos trasplantados. Obviamente su función fisiológica no era esa, dado que los trasplantes no se producen en la Naturaleza. En un principio se creía que se hallaban adscritos a la membrana de los leucocitos, de ahí su denominación antígenos leucocitarios humanos, más conocido por su acrónimo en inglés HLA (Human Leukocytes Antigens).
Estos «antígenos de trasplante» se agrupan en dos tipos: clase I, y clase II. No todos los genes del complejo mayor de histocompatibilidad se expresan de manera simultánea; en general solo se expresan entre 3 y 6 proteínas de cada clase.
Rolf Zinkernagel y Peter Doherty descubrieron en 1974 que algunas cepas de ratones morían tras la infección con el virus de la coriomeningitis linfocítica, mientras otras sobrevivían. En respuesta al virus, los animales infectados producían linfocitos T citotóxicos que atacaban al propio sistema nervioso del animal. Se desencadenaba, en algunos animales, una reacción autoinmune letal. Se demostró que la capacidad de producir este tipo de linfocitos se hallaba asociada a la expresión de un conjunto de genes del complejo mayor de histocompatibilidad. A este hecho se le denominó con el sintagma reconocimiento del antígeno restringido por complejo mayor de histocompatibilidad).
A esta interesante observación les siguieron otras: las células B, aun cuando tienen la capacidad de reconocer antígenos directamente, no sintetizaban eficazmente anticuerpos si previamente no se había producido su activación por los linfocitos T coadyuvantes. Esta activación solo se producía si los antígenos se asociaban con proteínas MHC clase II.
Emil R. Unanue y Howard M. Grey observaron que para desencadenar una respuesta inmunitaria, las proteínas foráneas (extrañas) debían penetrar mediante endocitosis en una célula presentadora de antígeno. Una vez en el interior celular, el antígeno (generalmente una proteína) experimenta clivaje hasta péptidos. Éstos se engarzan a moléculas del complejo mayor de histocompatibilidad clase I o clase II y se exponen en la membrana exterior de la célula formando una estructura reconocible por los linfocitos T, coadyuvantes o citotóxicos. A este mecanismo se le denominó «procesado del antígeno».
Mientras las proteínas del complejo mayor de histocompatibilidad clase II actúan en el procesamiento del antígeno en las «células presentadoras de antígenos» especializadas (macrófagos, células dendríticas, linfocitos B), un mecanismo similar ocurre en todas las células nucleadas del organismo, si bien en este caso intervienen las moléculas del complejo mayor de histocompatibilidad clase I.
Zaragoza, a 15 de enero de 2019
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Farmacia Las Fuentes
Florentino Ballesteros, 11-13
50002 Zaragoza