Los cánceres no son contagiosos en el sentido de no transmisibilidad entre pacientes. Sin embargo, según algunas estimaciones, en países desarrollados uno de cada seis cánceres tiene etiología infecciosa; proporción mucho más elevada en países con bajos estándares de desarrollo. Otros microorganismos, tales como la bacteria Gram negativa Helicobacter pylori y las infecciones por helmintos se asocian también con cánceres gástricos y de la vejiga urinaria respectivamente.
La vinculación entre algunos cánceres humanos y virus se remonta a las observaciones epidemiológicas de Domenico Rigoni-Stern en 1842. A partir de los registros de mortalidad de la ciudad italiana de Verona durante el período comprendido entre 1760 y 1839 concluyó que las monjas tenían una mayor incidencia de cáncer de mama y menor incidencia de cáncer cervical, a diferencia de las mujeres casadas y las prostitutas La probabilidad de cáncer de cérvix está directamente relacionada con una vida sexual activa (hoy se sabe dependiente de la infección crónica con diversos serotipos del virus del papiloma humano). Ciento veinte años después de aquellas observaciones, el Premio Nobel de Fisiología o Medicina de 1966 se concedió ex aequo a Charles Brenton Huggins por su descubrimiento del tratamiento hormonal del cáncer genital, y a Peyton Rous por el descubrimiento 55 años atrás del sarcoma epónimo en los pollos. El caso de Peyton Rous es paradigmático del período más prolongado (55 años) entre un descubrimiento científico y la concesión del Premio Nobel. Tuvieron que transcurrir otros 42 años hasta que Harald zur Hausen recibiera el Premio Nobel de Fisiología o Medicina (ex aequo Franςoise Barré-Sinoussi y Luc Montaigner) por el descubrimiento de los serotipos del virus del papiloma humano responsables de la mayoría de los cánceres cervicales.
Los estudios sobre virus tumorales han sido reconocidos con otros Premios Nobel: Renato Dulbecco, David Baltimore y Howard M. Temin (1975) por sus investigaciones sobre la transformación maligna de las células in vitro inducidas por virus; Baruch S. Blumberg en 1976 por su estudio del virus de la hepatitis B que condujo al desarrollo de una vacuna en 1969 (ex aequo Irving Millman; J. Michael Bishop y Harold E. Varmus por el origen celular de los oncogenes retrovirales; y Richard J. Roberts y Philip A. Sharp en 1993 por el descubrimiento de los mecanismos de escisión génica (splicing) en los adenovirus.
Los estudios de virus tumorales han conducido al descubrimiento, hasta ahora, de más de 30 oncogenes celulares, así como al hallazgo de genes supresores tumorales. Los oncogenes celulares llevan el prefijo “c” (verbigracia: c-myc, c-erb, c-fos), mientras los oncogenes transportados por virus llevan el prefijo “v” (por ejemplo: v-myc, v-ras). Por lo que respecta a los genes supresores tumorales los dos más importantes son la proteína p53, y PI3K (Phospho-Inositol-3–Kinase).
Ha transcurrido medio siglo del descubrimiento del primer virus oncogénico humano: el virus Epstein-Barr (también designado EBV o HHV4). Hoy día (2021) se han identificado siete virus oncogénicos:
- Virus Epstein-Barr
- Pertenece a los herpesvirus (dsDNA[1]).
- Descubierto en 1964.
- Relacionado con las siguientes enfermedades:
- Mononucleosis infecciosa («enfermedad del beso»).
- Síndrome de Duncan (síndrome linfoproliferativo. ligado al cromosoma X).
- Linfoma difuso de células B.
- Linfoma de Hodgkin.
- Carcinoma nasofaríngeo indiferenciado.
- Adenocarcinoma gástrico.
- Leiomiosarcoma.
- Enfermedad linfoproliferativa post-trasplante.
- Virus hepatitis B
- Pertenece a los hepadnavirus (dsDNA-RT).
- Descubierto en 1965.
- Relacionado con las siguientes enfermedades:
- Hepatitis.
- Cirrosis hepática.
- Carcinoma hepatocelular.
- HTLV-1 (Human T–Lymphotropic Virus-1)
- Pertenece a los retrovirus [(+)ssRNA-RT]
- Descubierto en 1980.
- Relacionado con las siguientes enfermedades:
- Mielopatía HTLV-1
- Paraplejia espástica tropical.
- Leucemia de células T del adulto.
- Virus del papiloma genital humano.
- Pertenece a los papilomavirus.
- Descubierto en 1983.
- Relacionado con las siguientes enfermedades:
- Carcinoma cervical.
- Carcinoma escamoso de cabeza y cuello.
- Cáncer escamoso anal.
- Cáncer de vulva.
- Virus hepatitis C.
- Pertenece a los flavivirus (+ssRNA-RT)
- Descubierto en 1989.
- Relacionado con las siguientes enfermedades:
- Hepatitis.
- Cirrosis hepática.
- Carcinoma hepatocelular.
- Herpesvirus sarcoma Kaposi (KSHV/HHV8).
- Pertenece a los herpesvirus (dsDNA)
- Descubierto en 1994.
- Relacionado con las siguientes enfermedades:
- Sarcoma de Kaposi.
- Enfermedad de Castleman.
- Linfoma efusión primario.
- Poliomavirus de células de Merkel (dsDNA).
- Pertenece a los poliomavirus.
- Descubierto en 2008.
- Relacionado con las siguientes enfermedades:
- Carcinoma de células de Merkel.
Uno de los logros derivados del descubrimiento de virus oncogénicos ha sido el desarrollo de vacunas contra los serotipos más comúnmente asociados al virus del papiloma humano, y contra la hepatitis B.
La importancia atribuida a los virus como agentes carcinogénicos ha experimentado altibajos desde la iniciativa, con rango de Ley (National Cancer Act) de 1971 durante Administración del presidente estadounidense Richard Nixon, Los virus pasaron de ser considerados responsables de la mayoría de los cánceres a ser irrelevantes en la aparición de enfermedades tumorales. Con la información hoy día disponible, el número de virus indubitadamente oncogénicos es reducido (7), pero nos hallamos lejos de una estimación objetiva. La inmensidad del viroma hace imprudente las conclusiones parciales y reduccionistas.
Describo a continuación algunos de los virus oncogénicos más importantes:
VIRUS PAPILOMA HUMANO
Los virus del papiloma humano contienen ADN (adenovirus). Este virus infecta los epitelios cutáneo y mucoso de la piel, región ano-genital y tracto oro-faríngeo.
La familia Papillomaviridæ contiene alrededor de 100 géneros distribuidos entre los α-papilomavirus (responsables de infecciones de la mucosa genital) y β-papilomavirus (causantes de epidermoplasia genital verrugosa).
Aproximadamente 40 géneros se han relacionado con cánceres cervicales (en mujeres), ano-genitales y oro-faríngeos (en ambos sexos).
Harald zur Hausen se centró en la identificación de ácidos nucleicos de origen viral en tejidos tumorales. A partir del virus del papiloma humano serotipo 6, mediante técnicas de hibridación logró aislar los serotipos 16 y 18 del virus, tanto en tejidos tumorales como en células HeLa. Es el clásico ejemplo de cómo el hallazgo de ácido nucleico viral condujo al aislamiento de nuevos serotipos víricos.
El cáncer cervical es el cuarto más común en todo el mundo, y el segundo en los países en desarrollo. Los serotipos más prevalentes son el HPV-16 y HPV-18 (responsables de entre el 70 y 80% de todos los cánceres cervicales, y algunos ano-genitales y oro-faríngeos.
Los virus del papiloma humano también se asocian con verrugas sub-clínicas, que en ocasiones pueden derivar el desarrollo de carcinomas.
La infección por el virus de papiloma humano es la infección genital más común en todo el mundo. Su prevalencia en mujeres sin anormalidades cervicales se halla entre el 11 y 12% con su peculiar distribución geográfica: en el África sub-sahariana (24%), Europa del este (21%) y Centro y Sudamérica (aproximadamente 16%). La prevalencia de la infección tiene dos máximos, el primero alrededor de 34 años; y tras una progresiva disminución, un segundo repunte alrededor de los 45 años.
Los niños nacidos por parto vaginal tienen una proporción más alta de virus de papiloma humano en relación a los nacidos por cesárea.
Los dos test para la detección del virus del papiloma humano son la detección de anticuerpos y el examen de frotis vaginales (test de Papanicolau, más conocido por su abreviatura «test Pap»).
Las primeras vacunas se desarrollaron frente los serotipos 6, 11, 16 y 18 (los más prevalentes), ampliándose su cobertura a 9 serotipos.
VIRUS HEPATITIS B
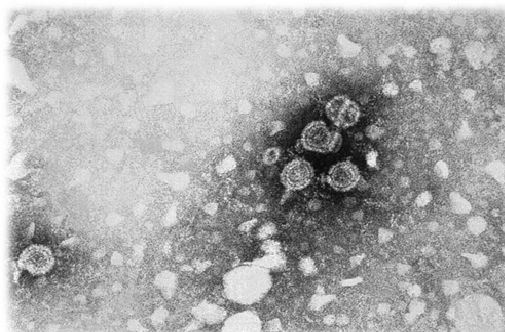 El virus de la hepatitis B (HBV) es un adenovirus perteneciente a la familia Hepadnaviridæ. Tiene tropismo por los hepatocitos, y puede causar hepatitis aguda o crónica, cirrosis hepática y carcinoma hepatocelular. También se le ha vinculado con linfomas no-Hodgkin y colangiocarcinomas.
El virus de la hepatitis B (HBV) es un adenovirus perteneciente a la familia Hepadnaviridæ. Tiene tropismo por los hepatocitos, y puede causar hepatitis aguda o crónica, cirrosis hepática y carcinoma hepatocelular. También se le ha vinculado con linfomas no-Hodgkin y colangiocarcinomas.
El descubrimiento del virus de la hepatitis B siguió al hallazgo de marcadores (proteínas) víricas. Barcuh Blumberg describió durante la década de 1960 la presencia del denominado antígeno Australia (por haberse aislado de la sangre de un aborigen australiano). Al principio se le consideró un nuevo tipo de grupo sanguíneo genético. Sin embargo, Harvey Alter, Baruch Blumberg y Alfred Prince descifraron que se trataba del antígeno de un virus, descrito posteriormente como virus de la hepatitis B.
Se estima que una cuarta parte (alrededor de dos mil millones de personas) están infectadas, de las que alrededor de 50 millones desarrollan cada año patología asociada al virus; y más de un millón fallecen (debido a cirrosis o carcinoma hepático).
La seroprevalencia varía geográficamente de zonas poco endémicas (~1%), a otras intermedias (2%-8%) – Oriente Medio e India-, hasta 8% en regiones sub-saharianas, este de Asia y todo Sudamérica.
Se han identificado al menos 10 serotipos, cada uno con su particular distribución geográfica.
La hepatitis B crónica aparece cuando el sistema inmune no puede eliminar el virus, o reducir la carga viral. La infección por HBV es máxima durante la primera infancia (85-90%), disminuyendo hasta la adultez (~5%). Ello se debe a que durante los primeros años de vida, el sistema inmunitario, todavía inmaduro, considera los antígenos del HBV como propios, y no reacciona frente a ellos. La transmisión vertical (de madre a hijo) ocurre durante el embarazo o el post-parto. La detección de antígenos de superficie [del virus], HBeAg, o la presencia de ADN viral en suero materno incrementa el riesgo de infección perinatal y el subsiguiente desarrollo de hepatitis B crónica durante la infancia. Además, existe una indubitada susceptibilidad genética. [HBeAg, es el acrónimo de Hepatitis B envelope Antigen].
En regiones no-endémicas la infección se adquiere a partir de la adolescencia, siendo las principales vías de contagio la actividad sexual y la compartición de jeringuillas en drogadictos con opiáceos.
Desde 1982 existe una vacuna anti-hepatitis-B. La vacunación neonatal ha tenido su trasunto en una disminución de la prevalencia y la mortalidad debida a grave patología hepática (cirrosis o carcinoma).
Las mujeres embarazadas positivas para los antígenos HBsAg y HBeAg deberían recibir tratamiento antiviral durante el primer trimestre o muy al comienzo del segundo para disminuir la carga viral previa al alumbramiento.
VIRUS HEPATITIS C
Hacia el año 1989 se observó que algunos cuadros clínicos de hepatitis no eran achacables a los virus de las hepatitis A y B, entonces conocidos. Haciendo alarde de originalidad al virus que se suponía causante de estas hepatitis se le denominó «no-A, no-B». A partir del ADNc (ADN copia) aislado de los hepatocitos de los pacientes se llegó al nuevo virus, designado virus de la hepatitis C.
En ausencia de tratamiento entre un 55% y un 85% de los infectados no logra eliminar el virus de su sangre al cabo de seis meses. Entre el 20% y el 30% de los infectados desarrollarán cirrosis hepática; y, de éstos, el 1% sufrirá carcinoma hepático.
El virus de la hepatitis C también se relaciona con linfoma no-Hodgkin y colangiocarcinoma.
La ruta de contagio es sanguínea. La determinación de su presencia en las trasfusiones de sangre y derivados hemáticos ha reducido drásticamente su prevalencia.
Se estima que alrededor de 180 millones de personas están infectadas con el virus de la hepatitis C, con una incidencia anual de nuevos casos de entre 3 y 4 millones. La seroprevalencia se halla en el rango 0,5% al 15%, siguiendo el patrón geográfico habitual (consultar bajo el epígrafe «Virus de la hepatitis B»). Egipto es el país con mayor prevalencia mundial atribuido a las campañas de erradicación de la esquistosomiasis.
Se han identificado 67 genotipos, cada uno con su particular distribución geográfica; de éstos, los genotipos 1 y 4 son especialmente virulentos, si bien todos pueden causar hepatitis C crónica y carcinoma hepatocelular.
No existe una vacuna anti-hepatitis-C, pero se han desarrollado eficaces fármacos, el más reciente, y sujeto a polémica por su elevado precio, es el Sofosbuvir. (Sovaldi®).
VIRUS EPSTEIN-BARR (EBV o HHV-4)
HHV4, acrónimo de Human Herpes-Virus type 4.
 El virus Epstein Barr (también designado por los acrónimos EBV y HHV-4) es un adenovirus ꝩ-1 del grupo de los herpesvirus. Fue el primer virus oncogénico que se descubrió tras relacionarlo con el linfoma de Burkitt hace más de medio siglo. Así mismo fue el primer virus humano cuyo genoma se logró secuenciar, en el año 1984. Ello permitió establecer su implicación en diversos cánceres linfoides (linfoma de Burkitt endémico, linfomas de Hodgkin y no-Hodgkin), cánceres epiteliales (nasofaríngeos y diversos cánceres gástricos); así como en el leiomiosarcoma pediátrico.
El virus Epstein Barr (también designado por los acrónimos EBV y HHV-4) es un adenovirus ꝩ-1 del grupo de los herpesvirus. Fue el primer virus oncogénico que se descubrió tras relacionarlo con el linfoma de Burkitt hace más de medio siglo. Así mismo fue el primer virus humano cuyo genoma se logró secuenciar, en el año 1984. Ello permitió establecer su implicación en diversos cánceres linfoides (linfoma de Burkitt endémico, linfomas de Hodgkin y no-Hodgkin), cánceres epiteliales (nasofaríngeos y diversos cánceres gástricos); así como en el leiomiosarcoma pediátrico.
El descubrimiento del virus Epstein-Barr fue secundario al hallazgo de Poiesz de actividad transcriptasa inversa en los sobrenadantes de cultivos de células T extraídos de linfomas cutáneos (una versión de leucemias de células T del adulto). Los ulteriores estudios por microscopía electrónica confirmaron la presencia de partículas retrovirales tipo C (HTLV-1). Epstein, Achongg y Barr descubrieron más tarde la relación de este virus con el linfoma de Burkitt.
Alrededor del 90% de la población adulta mundial está infectado con el EBV, la mayoría de forma latente a lo largo de sus vidas. Los linfocitos B «de memoria» en sangre periférica actúan como reservorios del virus. La infección durante la adolescencia o primera adultez da lugar en aproximadamente la mitad de los casos a mononucleosis («enfermedad del beso»). El virus Epstein Barr está presente en la leche materna, secreciones genitales y sangre. La infección por el EBV es causa de la enfermedad linfoproliferativa post-trasplante de órganos.
La prevalencia de anticuerpos anti-EBV es más elevada en personas jóvenes de familias con rentas medias o altas, independientemente de otros factores, como la genética o el origen étnico.
En personas con una inmunidad normal el virus permanece latente porque el sistema inmune destruye la formación de nuevos viriones. En condiciones de inmunodeficiencia el virus entra en su fase lítica, sintetizando proteínas con capacidad oncogénica.
HERPESVIRUS DEL SARCOMA DE KAPOSI
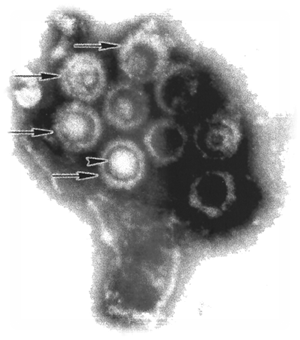 El herpesvirus del sarcoma de Kaposi es un adenovirus encuadrado en los radinovirus. Se identificó por primera vez en el año 1994 en las células en forma de huso del sarcoma de Kaposi que era frecuente en pacientes con SIDA. Con posterioridad, también se aisló en células endoteliales circulantes, fibroblastos, macrófagos, células dendríticas, linfocitos B, querotinocitos y células que tapizan el epitelio de la próstata.
El herpesvirus del sarcoma de Kaposi es un adenovirus encuadrado en los radinovirus. Se identificó por primera vez en el año 1994 en las células en forma de huso del sarcoma de Kaposi que era frecuente en pacientes con SIDA. Con posterioridad, también se aisló en células endoteliales circulantes, fibroblastos, macrófagos, células dendríticas, linfocitos B, querotinocitos y células que tapizan el epitelio de la próstata.
Sin embargo, su identificación fue algo más compleja: primero se aislaron genes de origen vírico en las células cancerosas del sarcoma de Kaposi. Chang y sus colaboradores aislaron el ADN de un herpesvirus presentes en las células del tumor [sarcoma de Kaposi], pero no de los tejidos sanos del mismo paciente. Ello condujo al aislamiento de las partículas víricas completas (EBV o HHV8) tanto en el sarcoma de Kaposi como en pacientes con la enfermedad de Castleman.
Los linfocitos B-CD19+ actúan como reservorios del virus. Dado que el ADN vírico se integra en el genoma celular, cuando los linfocitos B-CD19+ se dividen, también se multiplica el genoma vírico. [CD es el acrónimo de Cluster of Differentation].
La infección por el herpesvirus del sarcoma de Kaposi (KSHV) es habitualmente asintomática. Las personas con un sistema inmunológico competente impiden la reactivación lítica del virus. Bajo condiciones de inmunodepresión, tales como infección por VIH-1) o en pacientes trasplantados inmunodeprimidos farmacológicamente, aparece fiebre, esplenomegalia, pancitopenia e hiperplasia linfoide. En un estadio más avanzado, aparece sarcoma de Kaposi y una variante de la enfermedad de Castleman.
Mientras en Norteamérica y en la Europa no-mediterránea la seroprevalencia no supera el 3%, en algunas partes de África llega a casi el 70%, siendo Egipto uno de los países más afectados. La prevalencia en los países bañados por el Mediterráneo es intermedia, entre 10% y 30%.
VIH-1 (Virus Inmunodeficiencia Humano tipo 1)
VIH-1 es un retrovirus (virus con ARN) perteneciente a la sub-familia Orthoretroviridæ. Se identificó como microorganismo causal del SIDA en 1983. La infección por VIH-1 destruye la estirpe de linfocitos T-CD4+ causando una grave inmunodeficiencia que abre la puerta a diversas infecciones bacterianas, fúngicas o virales (algunas oportunistas), derivas cancerosas (sarcoma de Kaposi, linfomas Hodgkin y no-Hodgkin por virus Epstein Barr, leiomiosarcoma pediátrico), infecciones por hepatitis B y/o C, carcinoma de células de Merkel, e cánceres cervicales por el virus de papiloma humano, y cáncer conjuntival, entre otros.
La seroprevalencia más elevada por VIH-1 se presenta en el este y sur de África (más del 7% de todas las personas en el rango etario de 15 a 49 años), centro y oeste de África (2,2%), Europa del Este y Asia Central (0,9%), Centroamérica y los países bañados por el mar Caribe (aproximadamente 0,5%), norte de África y Oriente Medio (0,1%), y Europa, Norteamérica, Japón, Australia y otros países del Océano Pacífico (alrededor del 0,2%).
Según algunas estimaciones desde su surgimiento más allá del bosque lluvioso africano a comienzos de la década de 1980 la epidemia del SIDA ha causado más de 35 millones de muertos en todo el mundo. La mortalidad se redujo en alrededor del 45% gracias a los nuevos y cada vez más optimizados tratamientos que si bien no son curativos, la han convertido en una enfermedad crónica.
Las tres vías de contagio son por actividad sexual con personas infectadas, vía sanguínea o transmisión madre a hijo durante el embarazo. Los modelos de transmisión están muy condicionados por la cultura y la geografía. Por ejemplo, la transmisión heterosexual representa aproximadamente el 80% de los casos en el África sub-sahariana. En Filipinas e Indonesia, donde la incidencia continúa aumentando, el uso de drogas intravenosas (compartición de jeringuillas) es la vía de transmisión más usual.
Sin embargo, desde el año 2009 los nuevos contagios se han reducido un 45% (desde 330.000 a 170.000) en 21 países de África, en parte por el suministro prioritario de medicamentos antiretrovirales a embarazadas, dentro del programa United Nations Global Plan.
Hoy día existen dos modelos de terapia designados por los acrónimos HAART (Highly Active Anti-Retroviral Therapy) y cART (combination Anti-Retroviral Therapy). Un programa de Naciones Unidas dirigido a que el 90% de la población mundial infectada tuviese acceso a la terapia cART en 2020 se ha visto trastocado por la actual pandemia covid-19.
Otro proyecto (en el que farmacéuticos de una región brasileña participan activamente como prescriptores de antiretrovirales) denominado PreP (Profilaxis post-exposición) suministra medicamentos a personas de grupos de alto riesgo a los que se monitoriza posteriormente.
HTLV-1 (Human T-cell Lymphotropic Virus-1)
 HTLV-1 fue el primer retrovirus humano del que se demostró su capacidad oncogénica tras su aislamiento en el año 1979 a partir de un paciente con linfoma cutáneo de células T. El ARN del virus infecta linfocitos T-CD4+ y, en menor medida, linfocitos T-CD8+. Por esta razón durante algunos años se le consideró el virus causante del SIDA. Tras la infección el ARN se retrotranscribe a ADN que se integra en el ADN cromosómico celular. Se multiplica aprovechando la del propio ADN de la célula que lo alberga.
HTLV-1 fue el primer retrovirus humano del que se demostró su capacidad oncogénica tras su aislamiento en el año 1979 a partir de un paciente con linfoma cutáneo de células T. El ARN del virus infecta linfocitos T-CD4+ y, en menor medida, linfocitos T-CD8+. Por esta razón durante algunos años se le consideró el virus causante del SIDA. Tras la infección el ARN se retrotranscribe a ADN que se integra en el ADN cromosómico celular. Se multiplica aprovechando la del propio ADN de la célula que lo alberga.
HTLV1 infecta también otras estirpes celulares: células dendríticas, monocitos/macrófagos, fibroblastos, células endoteliales y linfocitos B.
HTLV-1 es un factor causal de la leucemia/linfoma de células T, y criterio confirmativo para el diagnóstico de la enfermedad.
Además, HTLV-1 también se asocia con un tipo de mielopatía crónica (paresia espástica tropical), así como un tipo no-maligno de uveítis.
La infección por HTLV-1 oscila afecta a entre 15 y 20 millones de personas, con mayor incidencia en el sur de Japón, África sub-sahariana y el archipiélago de las Seychelles (en el Océano Índico).
La presencia del virus (o sus genes integrados en el cromosoma celular) es un factor necesario, pero no suficiente, para la deriva tumoral Además, la leucemia/linfoma de células T tiene un prolongado período de latencia, entre 40 y 60 años, y solo se desarrolla entre el 3% y 5% de los portadores del HTLV-1.
POLIOMAVIRUS DE CÉLULAS DE MERKEL
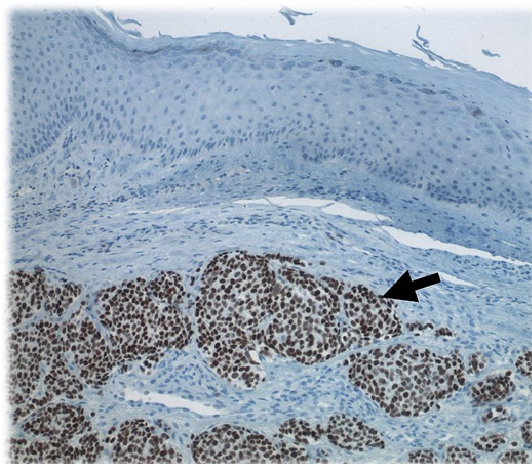 El poliomavirus de células de Merkel, descubierto en el año 2008, es mucho más común de lo que se pensaba. Su hallazgo fue secundario al estudio del carcinoma de células de Merkel. El virus se localiza en saliva, boca, tractos respiratorio y digestivo, sangre y orina. Un elevado porcentaje de la población es portadora asintomática del virus. La inmunosupresión aumenta la probabilidad de que el ADN viral mute y se integre en el ADN celular, circunstancia imprescindible para que pueda desarrollarse el carcinoma [de células de Merkel].
El poliomavirus de células de Merkel, descubierto en el año 2008, es mucho más común de lo que se pensaba. Su hallazgo fue secundario al estudio del carcinoma de células de Merkel. El virus se localiza en saliva, boca, tractos respiratorio y digestivo, sangre y orina. Un elevado porcentaje de la población es portadora asintomática del virus. La inmunosupresión aumenta la probabilidad de que el ADN viral mute y se integre en el ADN celular, circunstancia imprescindible para que pueda desarrollarse el carcinoma [de células de Merkel].
El aislamiento del polimavirus de células de Merkel fue el resultado de un sofisticado programa informático (Digital Transcriptome Subtraction) desarrollado por Harald zur Hausen para la secuenciación de genomas víricos a un coste asumible.
El carcinoma de células de Merkel es más común en hombres, tras trasplante de órganos y/o infección por VIH-1.
En muchos niños la infección aparece al interrumpir la lactancia materna cuando cesa abruptamente el aporte de anticuerpos maternos. La seroprevalencia aumenta hasta un 35% a 50% en la adultez tardía.
Los virus del carcinoma de Merkel son muy resistentes a las elevadas temperaturas, permaneciendo viables en objetos (fómites) durante períodos prolongados. El virus se transmite también por vía respiratoria, materno-infantil, contacto oral-fecal (está presente en aguas residuales), y contacto dérmico. Muchas personas sanas son portadoras del virus, haciendo imposible su erradicación. En la actualidad (enero 2021) no existe vacuna.
Zaragoza, a 26 de enero de 2021
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Farmacia Las Fuentes
Florentino Ballesteros, 11-13
50002 Zaragoza
[1] dsDNA significa que es un DNA de doble hebra (d: double; s: strand). Son virus clase 1 en la clasificación de Baltimore.