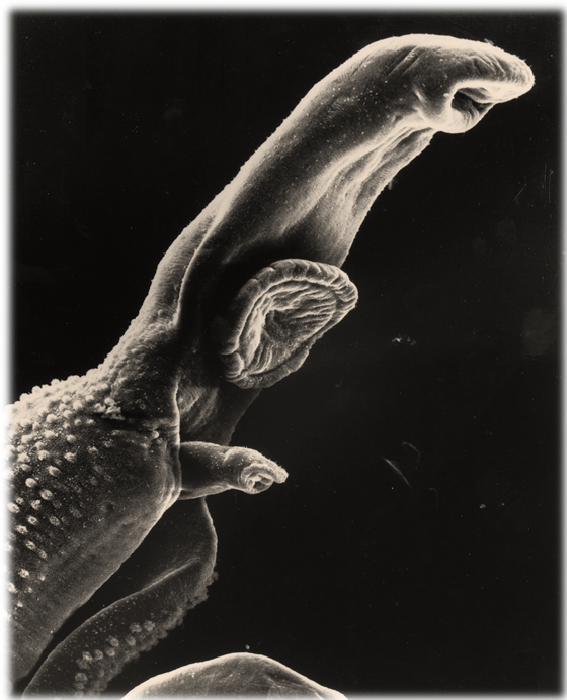
Schistosoma haematobium (macho y hembra acoplados)
Sinonimias: «trematodo sanguíneo de la vejiga», «bilharziasis vesical», «hematuria esquistosómica».
Durante milenios, la «hematuria esquistosómica» ha sido una infestación común en el valle del rio Nilo. Ha continuado siendo así desde entonces. Un elevado número de soldados de los ejércitos de Napoleón se infestaron durante su campaña militar en Egipto (1798-1801).
Theodor Maximiliam Bilharz, parasitólogo alemán (1852-1865) aisló en el año 1851 un gusano en las venas mesentéricas de un ciudadano de El Cairo. Sus estudios de campo demostraron que este gusano era responsable de la frecuente hematuria (sangre en orina) entre los campesinos que vivían en las orillas del Nilo. [T. M. Bilharz aisló también otro gusano cestodo, Hymenolepsis nana].
Pocos años más tarde, Harley halló este trematodo en el sur de África, denominándolo Bilharzia capensis (nombre específico referenciando a Ciudad del Cabo). Se trataba del mismo parásito. Esta circunstancia determina que nos refiramos a esquistosomiasis y bilharziasis como sinonimias.
Casi a la vez, el aislamiento de huevos con espolón lateral sugirió a Patrick Manson en 1893 la existencia de distintas especies de esquistosomas.
Sambon en el año 1907 designaría a los esquistosomas cuyas hembras depositan huevos con espina lateral Schistosoma mansoni, para distinguirlo del «trematodo sanguíneo de la vejiga», al que, en razón de su localización se le denominó Schistosoma haematobium. En esta misma época se tuvo conciencia que las formas larvarias de los esquistosomas medraban en distintas especies de caracoles que se comportaban de esta guisa como hospedadores intermediarios.
La prevalencia de la infestación por Schistosoma haematobium no se limita al valle del rio Nilo, sino que se extiende prácticamente por todo el resto de África, incluidas las islas Mascareñas, con excepción de las regiones desérticas (Sahara y el desierto de Namibia). Existen focos dispersos en la región del Magreb. Así mismo, se le encuentra en regiones de Irán, Iraq, península de Arabia e India (Mumbay). Hace años se notificaron casos aislados en el sur de Portugal.
Los proyectos de irrigación juegan en contra de los programas de erradicación de la infestación.
BIOLOGÍA DE SCHISTOSOMA HAEMATOBIUM
Los gusanos adultos son dioicos. Se localizan en la vejiga y plexos venosos de la pelvis.
Una hembra introducida en el canal ginecóforo del macho.
Al igual que con otras especies de esquistosomas, los machos son más pequeños y anchos (10-15mm x 0,1-1mm) que las hembras (20 x 0,25mm).
Tanto el macho como la hembra tienen ventosas que les posibilitan fijarse en sus localizaciones corporales.
El macho tiene un canal ginecóforo donde se aloja la hembra durante la cópula y la subsiguiente ovoposición.
El útero de una hembra aloja de sólito de 20 a 100 huevos ovoideos con espolón terminal. La ovoposición tiene lugar en las venas de los plexos vesical y pélvico; y, en menor medida, en las vénulas rectales, pulmonares; y más raramente en otras localizaciones.
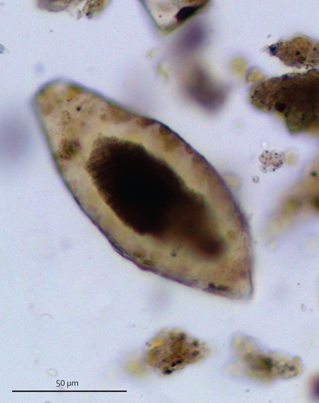 Cada huevo eliminado en orina o heces contiene una larva (miracidio) que, cuando las condiciones son favorables, abandona el huevo, nadando libre y erráticamente hasta que topa con un hospedador intermediario (distintas especies de caracol).
Cada huevo eliminado en orina o heces contiene una larva (miracidio) que, cuando las condiciones son favorables, abandona el huevo, nadando libre y erráticamente hasta que topa con un hospedador intermediario (distintas especies de caracol).
Una vez en el caracol, los miracidios (primer estado larvario) mutan en el transcurso de 4 a 8 semanas generándose esporocistos. A partir esta forma larvaria surgen las cercarias con cola bifurcada (último estadio larvario).
Los moluscos que actúan como hospedador intermediario para Schistosoma haematobium pertenecen a los géneros Bulinus, Phyopsis y Planorbarius.
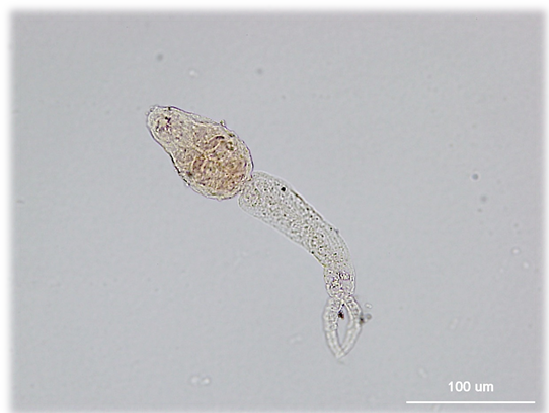 Cuando las cercarias abandonan el caracol en el que se han formado a partir de los miracidios, nadan con el espolón por delante a modo de quilla.
Cuando las cercarias abandonan el caracol en el que se han formado a partir de los miracidios, nadan con el espolón por delante a modo de quilla.
Cuando un humano camina descalzo por «aguas infestadas», las cercarias penetran en su organismo atravesando la piel, proceso durante el que se desprenden de su cola bifurcada. Al cabo de un día aproximadamente, las cercarias aparecen ya en las vénulas periféricas, desde donde viajan junto con la sangre venosa hasta las cavidades derechas del corazón (aurícula y ventrículo derechos). Desde allí son impelidas a los capilares pulmonares. Mientras algunas quedan atrapadas en ganglios linfáticos, la mayoría entran en la circulación arterial. Un número significativo de gusanos en distintos estadios de maduración se desvían hacia la arteria abdominal, pero únicamente sobreviven las que alcanzan la arteria mesentérica y el sistema portal hepático.
En los vasos sanguíneos intrahepáticos, los gusanos alcanzan su madurez sexual. Desde allí migran a los plexos pélvicos y vesicales. El periodo de prepatencia (intervalo temporal entre la entrada de las cercarias y la madurez sexual) es de aproximadamente tres meses. De diez a 12 semanas después del acoplamiento, las hembras llevan a cabo la ovoposición. Los huevos rompen las vénulas vesicales o rectales, siendo eliminados con orina (en la fracción final de la micción) o mezcladas con las heces.
PATOGÉNESIS

 Tras contactar con la piel humana, las cercarias atraviesan la epidermis, instalándose en los capilares de la dermis, desde donde alcanzan vasos sanguíneos de mayor calibre. No hay prácticamente daño en el tejido; y, por lo tanto, apenas se produce reacción tisular contra las cercarias. Desde los capilares alcanzan las vénulas próximas y las venas de mayor calibre hasta que llegan al corazón.
Tras contactar con la piel humana, las cercarias atraviesan la epidermis, instalándose en los capilares de la dermis, desde donde alcanzan vasos sanguíneos de mayor calibre. No hay prácticamente daño en el tejido; y, por lo tanto, apenas se produce reacción tisular contra las cercarias. Desde los capilares alcanzan las vénulas próximas y las venas de mayor calibre hasta que llegan al corazón.
Desde las cavidades derechas del corazón, los gusanos adultos, formados a partir de las cercarias invasoras, se alojan en las vénulas pulmonares. Algunos gusanos rompen los capilares y vénulas produciéndose micro-hemorragias. Se produce una infiltración eosinofílica contra los gusanos adultos.
Transcurridos unos 5 días desde la penetración de las cercarias, los ya gusanos adultos llegan y se alojan en la vena porta. Allí crecen hasta alcanzar su madurez sexual. La secreción de metabolitos tóxicos por los gusanos da lugar a una reacción inflamatoria perivascular aguda.
A las tres semanas de la infestación (penetración de las cercarias), los gusanos sexualmente maduros abandonan el plexo portal venoso hepático a través de la vénula mesentérica inferior, las hemorroidales y las venas pudendas, situándose en el plexo vesical.
Las hembras comienzan la ovoposición, entre 10 y 12 semanas después de la infestación. Recordemos que la característica diferencial de los huevos de Schistosoma haematobium es la presencia de un espolón lateral.
Durante todo el proceso, la liberación de metabolitos de los gusanos desencadena una importante reacción alérgica.
Cuando los huevos se descargan en las vénulas se produce otro tipo de lesión causada por los huevos que caen en la luz del órgano, junto con sangre extravasada y células del tejido necrótico. En la esquistosomiasis por Schistosoma haematobium esta situación se presenta de modo preferencial en la pared de la vejiga urinaria; así como en los órganos urinarios adyacentes, órganos sexuales y recto; y menos frecuentemente en los pulmones y otros órganos.
Los huevos que se infiltran en los tejidos dan lugar a la formación de abscesos. Aquellos que se ubican cerca de la vejiga pueden romperse cayendo en la luz del conducto vesical. Sin embargo, la mayoría permanecen en el tejido, que acaba por tornarse fibroso (necrosis tisular).
Así pues, la patogénesis causada por Schistosoma haematobium se puede resumir en: (1º) reacción alérgica a los metabolitos segregados desde el tegumento de los gusanos; (2º) microtraumatismos hemorrágicos cuando los huevos salen de las vénulas, bien quedando anclados en el tejido (fibrosis tisular) o cayendo en la luz del órgano; y (3º) formación de abscesos alrededor de los huevos.
Al igual que con otros esquistosomas (S. japonicum y S. mansoni), la infestación por Schistosoma haematobium tiene tres fases: incubación, producción e infiltración de huevos, y proliferación tisular y reparación.
Incubación.-
Su duración es de 10 a 12 semanas, desde el primer contacto de la piel con las cercarias hasta que las hembras realizan la ovoposición.
Hacia el final del período de incubación las manifestaciones clínicas incluyen anorexia, cefalea, malestar, dolor en tórax y extremidades, fiebre vespertina y sudoración nocturna. Los hemogramas evidencian leucocitosis y eosinofilia. Signos clínicos característicos son la hepatomegalia y esplenomegalia. La diarrea o disentería solo se evidencia cuando los gusanos maduran en las vénulas rectales.
Infiltración de los huevos.-
La presencia de huevos en orina se puede demorar varios meses desde la infestación. Suelen presentarse algunos síntomas prodrómicos: cefalea, dolor de espalda, astenia, fiebre vespertina, necesidad urgente de micción asociada a dolores sordos en la región supra-púbica, e incluso cólico renal. Se produce inflamación del trígono vesical (triángulo formado por los uréteres y el esfínter interno de la uretra).
La mayoría de los huevos se acumulan formando abscesos, a veces con forma tubular (seudotubérculos).
Proliferación tisular.-
Esta fase se inicia con la infiltración de los huevos y la consiguiente formación de abscesos. Se caracteriza por hiperplasia de la pared vesicular, e infección secundaria que semeja una cistitis crónica.
En los varones las lesiones suelen ser más graves al extenderse hacia el pene (fibrosis del prepucio y eventual elefantiasis debido al bloqueo de los ganglios linfáticos del escroto).
En las mujeres, es menos grave, aun cuando la vagina y útero pueden resultar afectados.
Durante esta fase, la sintomatología incluye debilidad extrema, emaciación, micciones cada vez más frecuentes, dolorosas e improductivas. Al final apenas se elimina sangre y pus. Cuando se llega a este estado el paciente fallece de modo irremediable.
El pronóstico de la «esquistosomiasis sanguínea de la vejiga» (Schistosoma haematobium) es favorable si aborda con prontitud y se evitan las reinfecciones. Sin embargo, es muy grave en los casos no tratados o cuando se abordan tardíamente.
TRATAMIENTO
El tratamiento sintomático es inútil si no se acompaña de quimioterapia específica.
Históricamente se usaban compuestos de antimonio (tartrato de antimonio y potasio, tartrato de antimonio y sodio, dimercaptosuccinato de antimonio); así como Niridazol y 1-metil-4-β-dietil-aminoetil-amino-tioxantona).
 Hoy día los medicamentos de elección son Praziquantel y Metrifonato.
Hoy día los medicamentos de elección son Praziquantel y Metrifonato.
 Metrifonato es un compuesto organofosforado cuyo metabolito – un isómero – (diclorvos) muestra actividad anticolinesterasa. Se usa también por sus propiedades insecticidas. Para contrarrestar la actividad colinérgica (parasimpaticomimética) del Metrifonato, se administra conjuntamente con Atropina, sin que interfiera con su actividad esquistosomicida.
Metrifonato es un compuesto organofosforado cuyo metabolito – un isómero – (diclorvos) muestra actividad anticolinesterasa. Se usa también por sus propiedades insecticidas. Para contrarrestar la actividad colinérgica (parasimpaticomimética) del Metrifonato, se administra conjuntamente con Atropina, sin que interfiera con su actividad esquistosomicida.
El grupo de trabajo dirigido por Schrader, en laboratorios Bayer, en Erbelfeld, sintetizaron Metrifonato en el año 1952. [Referencia bibliográfica: Lorenz, W., et al. The new insecticide O,O-dimethyl-2.2.2-trichloro-1-hydoxiethylphosphonate. J Am Chem Soc. 1955; 77: 2554-6].
Jacques Cerf, a la sazón en el Congo Belga (actual República Democrática del Congo) llevó a cabo un experimento con diez compuestos organofosforados estudiando su actividad helminticida frente a Ascaris lumbricoides que eran mantenidos en frascos de solución Ringer. De ellos, Metrifonato es el que parecía más eficaz. Jaques Cerf llevó a cabo varios ensayos en pacientes infestados con diversos gusanos, desde Ascaris lumbricoides hasta Ancylostoma duodenale. [Referencia bibliográfica: Cerf J., Lebrun A. A new approach to helminthiasis control: the use of an organophosphorous compound. Am J Trop Med Hyg 1962: 11: 514-17]. En todos los experimentos, la sustancia que produjo un mayor índice de resolución fue Metrifonato. Este fármaco comenzó a usarse masivamente en Egipto contra Schistosoma haematobium hasta la introducción de Praziquantel. [Referencia bibliográfica: Jesbury J.M., et al. Field trial of Metrofonate in the treatment and prevention of schistosomiasis infection in man. Ann Trop Med Parasit 1977; 71: 67-83].
La profilaxis del «trematodo sanguíneo de la vejiga» exige un programa en tres etapas:
- Erradicación de los hospedadores moluscos al menos durante el tiempo de un ciclo vital.
- Mejora de las infraestructuras sanitarias (alcantarillado, procesamiento de excretas humanas y animales, potabilización del agua, educación sanitaria para no caminar descalzo por «aguas infestadas»).
- Tratamiento de las personas infestadas. Este aspecto es fundamental, toda vez que los humanos, y no los hospedadores intermediarios (caracoles), son los responsables de la perpetuación del ciclo vicioso del parásito.
VACUNAS CONTRA LA ESQUISTOSOMIASIS
Desde la década de 1960 se ha estado investigando en potenciales vacunas antiesquistosómicas. Uno de los problemas es que la sintomatología asociada no se debe a los gusanos adultos, ni a la forma larvaria que infesta al hombre (cercaria), sino a los huevos y, aún más, a la reacción inmune del propio paciente frente a los huevos que quedan atrapados en los tejidos.
Una vacuna debería reducir la carga de gusanos adultos, disminuyendo la fecundidad de las hembras supervivientes y, consiguientemente, la ovoposición. Como resultado, se reduciría el número de miracidios (larva que emana de los huevos) que infestan a los caracoles hospedadores intermediarios. Por otra parte, los beneficios epidemiológicos de una vacuna eficaz tardarían no menos de dos décadas en evidenciarse.
De modo alternativo, una vacuna potencial que atacara estadios concretos del ciclo biológico del parásito podría ser, al menos teóricamente, más viable. Una de las estudiadas es Sh28 GST (acrónimo de «Schistosoma haematobium antígeno 28 asociado con Glutation-S-Transferasa»).
Otra estrategia consiste en asociar citoquinas con antígenos del parásito para potenciar su capacidad antigénica.
También se ha estudiado la asociación de antígenos tegumentarios del esquistosoma con subunidades de la toxina del cólera para suprimir o limitar la respuesta inflamatoria, responsable de una parte muy significativa de la sintomatología asociada a la infestación.
Y otra línea de investigación consiste en la utilización de distintos antígenos con el fin de ampliar la cobertura de la vacuna contra distintos estadios, desde su fase larvaria (cercarias) a los gusanos adultos, sexualmente maduros.
En la actualidad (primavera 2018) se ha iniciado un ensayo clínico en Holanda en el que participan voluntarios que se dejan infestar con el parásito en condiciones controladas (¿?).
Zaragoza, 16 de abril de 2018
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Farmacia Las Fuentes
Zaragoza