La fotografía corresponde a la pandemia de 1918-1919, denominada erróneamente «gripe española».
Hasta el momento (23 de enero de 2018) la campaña de gripe se considera moderada. La incidencia de gripe es similar (hasta ahora) a la de 2014-2015, que estuvo dominada por el serotipo H3N2 del virus influenza.
[Recordemos que la catalogación genotípica del virus de la gripe (influenza) se basa en los subtipos de dos proteínas de su cápside (envoltura proteica del ácido nucleico vírico). Helas aquí: H (hemaglutinina) y N (neuraminidasa)].
La cepa H3N2 es la más peligrosa de las cuatro que suelen causar la gripe estacional. Una gripe estacional típica mezcla dos cepas tipo A (H1N1, H3N2) y dos cepas tipo B (Victoria y Yamagata). Las cepas (serotipos) B de la gripe son causan infecciones banales, dado que el hombre es portador «natural» de este tipo de virus influenza. Las infecciones por los tipos B del virus de la gripe suelen aparecer al final de un brote por los serotipos del virus A.
A comienzos de enero (2018), el 78% de todas las muestras del virus de la gripe cuyo genoma se ha secuenciado son serotipo H3N2. Esta cepa (o serotipo) emergió en Hong Kong en el año 1968, causando la muerte ese año de alrededor de 1 millón de personas. A partir de entonces el serotipo H3N2 ha estado en circulación, sufriendo pequeñas mutaciones. La inmunidad parcial frente a este serotipo es amplia porque muchas personas han padecido la gripe (inmunidad natural); y, además, ha formado parte de todas las vacunas contra la gripe preparadas desde entonces (inmunidad adquirida).
A modo de resumen, las pandemias de gripe más notorias y el serotipo asociado:
- «Gripe española» (1918-1919): H1N1
- Gripe asiática (1957): H2N2
- Gripe de Hong-Kong (1968): H3N2
- Gripe aviar (2004): H5N1
- Gripe porcina (2009): H1N1 (el mismo serotipo de la denominada «gripe española»).
- Gripe porcina (2011-2012): H1N1
INCIDENCIA DE GRIPE
Dado que la gripe no es una enfermedad de declaración obligatoria, las estimaciones de su incidencia se obtienen mediante la extrapolación de encuestas realizadas entre médicos, así como en centros de salud y dispensarios.
La incidencia anual de gripe durante las últimas campañas ha rondado el 6% de la población, con la excepción del año 2011-2012, cuando la denominada «gripe porcina» (H1N1) fue predominante. Su incidencia fue más baja (2%) y el máximo de casos se produjo en octubre. Esto es habitual durante los escenarios de pandemia. [Recuérdese que pandemia no significa un número espectacular de casos, sino una extensión mundial].
La gripe puede afectar a cualquier persona, pero los riesgos dependen de la edad y su estado de salud general. Las personas con mayor riesgo son los ancianos (personas de 65 o más años), niños de menos de 5 años, y embarazadas. Determinadas patologías crónicas incrementan la probabilidad de complicaciones que requieran hospitalización, tales como asma, enfermedades pulmonares, diabetes mellitus e incluso obesidad.
El principal riesgo de la gripe deriva de sus posibles complicaciones, fundamentalmente neumonía, meningitis y sepsis. Éstas pueden afectar a personas sanas, pero sobre todo a niños muy pequeños o ancianos.
Australia, donde la gripe aparece cada año antes que en el resto del mundo ha sufrido una gripe catalogada de grave, con «elevada» mortandad. Aun cuando la campaña de la gripe todavía está inconclusa, la cobertura lograda por la vacuna se prevé que no supere el 30%, significativamente por encima de las primeras estimaciones, que la situaban en un 10%. No obstante, las directrices sanitarias australianas difieren de las de los países occidentales. Mientras en éstos la vacuna se recomienda a personas de riesgo, con independencia de su estado de salud, en Australia solo se administra a personas con patologías crónicas y que, por lo tanto, son especialmente vulnerables.
No obstante la baja cobertura lograda por la vacuna actual contra la gripe, la recomendación continúa siendo la vacunación anual. A pesar de sus deficiencias, la vacuna de la gripe disminuye drásticamente la posibilidad de graves, potencialmente mortales, complicaciones (neumonía, meningitis, sepsis).
Además de la vacuna, existen medicamentos de probada eficacia si se administran en los estadios iniciales del proceso infeccioso. Helas aquí: Oseltamivir (Tamiflu®), Zanamivir (Relenza®) y Peramivir (Rapivab®). Este último se administra por vía intravenosa, restringido al medio hospitalario.
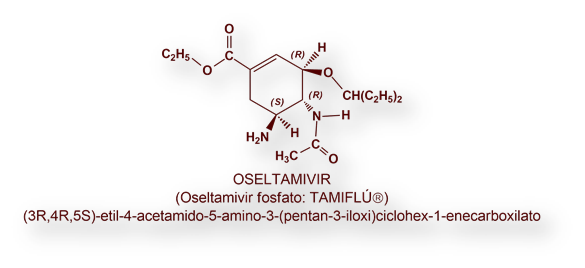
OSELTAMIVIR (TAMIFLÚ®)
Oseltamivir es un pro-fármaco del Oseltamivir carboxilato, un inhibidor de la enzima neuraminidasa (sinónima: sialidasa). Esta proteína (abreviadamente N), junto con la hemaglutinina (abreviadamente H), constituyen la base para la determinación del serotipo del virus de la gripe (influenza). La neuraminidasa tiene un papel fundamental para la infectividad y replicación de los virus influenza A y B.
Oseltamivir se usa en la post-exposición a los virus influenza A y B, incluyendo las cepas (serotipos) pandémicos.
Aun cuando Oseltamivir se administra como sal (fosfato), las dosis se expresan en términos de base (Oseltamivir), de tal suerte que 98,5mg de Oseltamivir fosfato equivalen a 75mg de Oseltamivir. La pauta habitual es 75mg b.i.d. (bis in die, o cada 12 horas) durante 5 días consecutivos. El efecto óptimo requiere que el tratamiento se inicie dentro de las 48 horas tras el debut de la sintomatología gripal.
En otros países (no en España) se comercializa una formulación para administración intravenosa de uso exclusivo en niños de menos de 1 año, bajo criterios de «uso compasivo».
Para posologías en situaciones especiales (niños muy pequeños, pacientes con la función renal comprometida) consultar con su farmacéutico.
Oseltamivir se ha ensayado para la profilaxis y tratamiento de la infección por la cepa H5N1 («gripe aviar»), hasta que se disponga de una vacuna efectiva.
ZANAMIVIR (RELENZA®)
 Zanamivir, al igual que Oseltamivir, es un «inhibidor de la actividad enzimática neuraminidasa vírica».
Zanamivir, al igual que Oseltamivir, es un «inhibidor de la actividad enzimática neuraminidasa vírica».
Se comercializa con el nombre registrado de Relenza® en alveolos para inhalación conteniendo 5mg. La posología es de 10mg (2 inhalaciones) cada 12 horas (10mg b.i.d.) durante 5 días consecutivos, iniciando el tratamiento dentro de las primeras 48 horas tras la aparición de los primeros síntomas.
Para las personas en riesgo de contagio (personas que, bien por razones familiares u ocupacionales se hallen en contacto estrecho con infectados), se recomienda una única dosis diaria de 10mg (10mg q.d.). En caso de brote epidémico, esta pauta profiláctica se debe mantener durante 28 días.
En los estudios post-comercialización (fase IV), sobre todo en Japón, se han comunicado efectos adversos neuropsiquiátricos, tipificados como alteraciones de la conducta. Se considera que puede tratarse de un «efecto de grupo farmacológico». Por lo tanto, cabe prever que también son posibles con otros medicamentos «inhibidores de la neuraminidasa».
Zanamivir se debe usar con precaución en pacientes con enfermedades respiratorias crónicas debido al riesgo de broncoespasmo. Si se usa en estos pacientes, se ha de tener a mano un broncodilatador de duración de acción prolongada. Cuando se desarrolla un cuadro de broncoespasmo, el tratamiento con Zanamivir se ha de interrumpir de inmediato.
PERAMIVIR (RAPIVAB®)
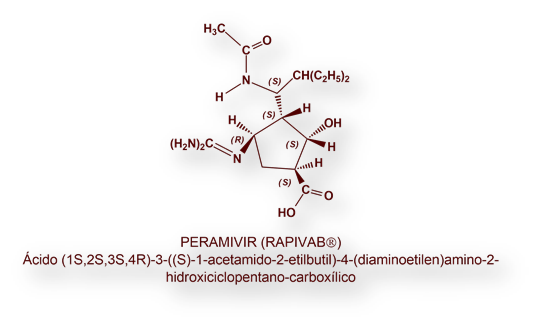 Peramivir es un «inhibidor de la enzima neuraminidasa», a semejanza de Oseltamivir y Zanamivir (ver antes).
Peramivir es un «inhibidor de la enzima neuraminidasa», a semejanza de Oseltamivir y Zanamivir (ver antes).
La estructura química de Peramivir se diseñó racionalmente partiendo de la observación de que la inhibición de la enzima neuraminidasa depende de las posiciones relativas de ácido siálico en la estructura tridimensional de la enzima. Se consiguió así un fármaco inhibidor potente y selectivo de la enzima neuraminidasa. Sin embargo, Peramivir no se absorbe por vía oral, a pesar de lo que se presupuso a partir de la eliminación previa de la cadena lateral de glicerol. Solo se formula, pues, para administración intravenosa (infusión).
[Referencia bibliográfica: Chand P., et al. Systematic structure-based design and stereoselective synthesis of novel multisubstituted cyclopentane derivatives with potent antiinfluenza activity. J Med Chem 2001; 44: 4397].
Peramivir inhibe selectivamente la actividad enzimática neuraminidasa (sialidasa). A bajas concentraciones (0,9-11 nM) inhibe la actividad neuraminidasa vírica; precisándose concentraciones de 3×105 nM para la inhibición de las sialidasas de mamífero (estudios en hepatocito de rata), bacteria (ensayos en Vibrio cholerae, Clostridium perfringens) o paramixovirus (estudios en virus de la enfermedad Newcastle, y parainfluenzae).
Para el tratamiento de la influenza no complicada, una dosis intravenosa (300 a 600mg) se administra en infusión durante un mínimo de 15 minutos. Si los síntomas persisten, se puede repetir la infusión intravenosa durante los días siguientes, hasta 5, o a lo sumo, 10 días. Es necesario reajustar la dosis en caso de insuficiencia renal (consultar con el farmacéutico).
La información sobre la eficacia y seguridad de Peramivir (no comercializado en España) es limitada. Para más detalles, consulte la ficha técnica o directamente a su farmacéutico.
Zaragoza, a 23 de enero de 2018
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Farmacia Las Fuentes
Zaragoza