La síntesis química del ácido acetil-salicílico (Aspirina®) se realizó en los años postreros del siglo XIX. Sin embargo, la historia que condujo a su descubrimiento comenzó mucho tiempo antes, en 1843, cuando August Wilhelm von Hofmann, alumno de Justus von Liebig (1803-1873), aisló anilina destilando alquitrán de hulla. Tres años después (1846), junto a Charles Mansfield, Hofmann obtuvo benceno a partir del alquitrán. ¡Todo muy negro y, a primera vista, muy poco farmacéutico!
La reacción del benceno con ácido nítrico fue el punto de partida para la fabricación industrial de colorantes derivados de la anilina.
 Una década más tarde (1856) William Perkin, alumno de August Wilhelm von Hofmann, trató de sintetizar Quinina partiendo de un derivado de la anilina, la alil-toluidina. No lo consiguió, pero, incidentalmente, obtuvo un colorante púrpura, al que pronto se denominó mauveína (otros nombres: malveína, anilina morada, púrpura de Perkin). A la mauveína se le considera el primer colorante sintético. En aquella época, el precio de los colorantes comprometía el desarrollo de la industria textil que se hallaba en auge tras el desarrollo de la máquina de hilar, contra la que había surgido la protesta de los artesanos encabezado por Ned Ludd durante la segunda década del siglo XIX. Las protestas contra la industrialización textil, en el que se incendiaban las nuevas fábricas, se conocería com «ludismo», patronímico de Ned Ludd.
Una década más tarde (1856) William Perkin, alumno de August Wilhelm von Hofmann, trató de sintetizar Quinina partiendo de un derivado de la anilina, la alil-toluidina. No lo consiguió, pero, incidentalmente, obtuvo un colorante púrpura, al que pronto se denominó mauveína (otros nombres: malveína, anilina morada, púrpura de Perkin). A la mauveína se le considera el primer colorante sintético. En aquella época, el precio de los colorantes comprometía el desarrollo de la industria textil que se hallaba en auge tras el desarrollo de la máquina de hilar, contra la que había surgido la protesta de los artesanos encabezado por Ned Ludd durante la segunda década del siglo XIX. Las protestas contra la industrialización textil, en el que se incendiaban las nuevas fábricas, se conocería com «ludismo», patronímico de Ned Ludd.
 El púrpura de Perkin fue punto de partida para la síntesis de nuevos colorantes derivados de la anilina, la toluidina y la quinolina.
El púrpura de Perkin fue punto de partida para la síntesis de nuevos colorantes derivados de la anilina, la toluidina y la quinolina.
Aunque la incipiente industria de los colorantes surgió en Inglaterra, su expansión se produjo en Alemania. Dos hechos fueron determinantes: de una parte el inicio de la recuperación tras el colapso económico de 1873 que siguió a los procesos revolucionarios de 1871; y de otra parte la expansión de las industrias eléctricas que paulatinamente desplazaron a otras, como el carbón y el acero. Fue así como, en pocos años, Alemania llegó a ser pionera en la industria de los colorantes.
Por otra parte, se inició en Alemania un vertiginoso desarrollo de la Química Orgánica y, subsiguientemente, de la industria farmacéutica, que se mantuvo vigente hasta la Segunda Guerra Mundial. El éxito germano en esta materia cabe atribuirlo a la estrecha vinculación entre la universidad y la industria, una relación inexistente en Inglaterra que no supo sacar provecho del descubrimiento de Perkin. Inglaterra no hizo honor a su refrán según el que «el éxito alimenta el éxito» (Success bred success).
El desarrollo de la industria de los colorantes impulsó a la entonces incipiente Industria Farmacéutica, representada por fabricantes como F. Bayer & Co., y Farbenfabriken Hoechst.
La industria farmacéutica de Gran Bretaña, Francia, Estados Unidos, Canadá (origen de la insulina) y, en mucha menor extensión Suiza, se centraba en la extracción de alcaloides y glucósidos de diversas plantas. La investigación de fármacos de síntesis no se consideraba una línea de investigación prometedora. Los recortes de medicamentos, muchos procedentes de Alemania, durante los años de entreguerras y, aún más, durante la Segunda Guerra Mundial obligaron a un replanteamiento de estos principios rectores.
Gran parte de los productos de origen natural, vegetal en gran medida, pero también de origen animal (heparina e insulina, verbigracia) surgían de la investigación académica sin participación de la industria, al menos en las etapas iniciales. El escenario era distinto con los fármacos sintéticos. Con excepción de un puñado de hipnóticos, la mayoría de los medicamentos de síntesis se obtenían en laboratorios de la industria tales como el Instituto de Terapia Experimental establecido por Paul Ehrlich en Frankfort.
Descubrimiento del fenol (primero denominado: ácido carbólico).
 En 1792 William Murdock comenzó a usar los gases desprendidos de la combustión de la madera, la turba y la hulla para iluminación, primero de su hogar en Redruth, Cornualles; y siete años más tarde en Birmingham, la primera ciudad, a la que siguieron Londres y Preston en 1816. Un año más tarde (1817) Baltimore (Estados Unidos) se convirtió en la primera ciudad americana que se iluminó por gas.
En 1792 William Murdock comenzó a usar los gases desprendidos de la combustión de la madera, la turba y la hulla para iluminación, primero de su hogar en Redruth, Cornualles; y siete años más tarde en Birmingham, la primera ciudad, a la que siguieron Londres y Preston en 1816. Un año más tarde (1817) Baltimore (Estados Unidos) se convirtió en la primera ciudad americana que se iluminó por gas.
Uno de los subproductos del proceso de combustión para la obtención del gas era un aceite de carácter ácido al que Friedlieb Rungen lo denominó ácido carbólico. Más tarde (1842) Charles Gerhardt le dio el nombre que ha perdurado: fenol.
 Charles Gerhardt observó muy pronto que el fenol era un buen conservante que prevenía la putrefacción de los tejidos animales y la madera. Sin embargo era demasiado costoso para comercializarlo con ese fin.
Charles Gerhardt observó muy pronto que el fenol era un buen conservante que prevenía la putrefacción de los tejidos animales y la madera. Sin embargo era demasiado costoso para comercializarlo con ese fin.
En 1844 Henry Louis Bayard preparó un polvo, mezcla de arcilla con alquitrán de hulla, que se podía utilizar como fertilizante. Fue galardonado por la Société d’Encouragement por su contribución a la higiene en las granjas.
Sin embargo, la primera persona que explotó industrialmente las propiedades desinfectantes del fenol fue Frederick Calvert, quien había trabajado en Francia entre 1835 y 1846, antes de regresar a Manchester (Gran Bretaña), donde introdujo el fenol en las prácticas de embalsamamiento. Se involucró también con los descubridores del llamado «polvo de McDougall» (McDougall’s Power), una mezcla de sales de calcio y fenol patentada en 1845, y utilizada para purificar el agua destinada al consumo y desodorizar las aguas residuales. Las aplicaciones se ampliaron a la desinfección de establos, granjas, e incluso úlceras humanas y animales.
Pronto quedó claro que el compuesto desinfectante del «polvo de McDouglas» era el fenol, tal como se dio a conocer en la Academia de Ciencias en 1859.
Enseguida, Friedrich Küchenmeister, un médico de Dresde (Alemania) comenzó a impregnar con fenol los vendajes usados en las heridas. Jules Lemaire, publicó un libro en 1865 titulado «L’Acid Phénique» en el que se propugnaba el empleo del fenol en la entonces incipiente praxis quirúrgica. El libro tuvo escasa repercusión en Gran Bretaña, donde, recordemos, todo había comenzado.
En un libro («Nouvelles Applications de l’Acid Phénique en Médecin et en Chirurgie») publicado por Gilbert Declat en 1865, se refería al fenol como parasiticida. Se recomendaba su uso en la profilaxis de las infecciones e incluso en el lavado de las paredes de las habitaciones de los enfermos.
La mayoría de los cirujanos británicos ignoraban los ensayos con el fenol llevados a cabo en Francia. Uno de los que finalmente aceptó los trabajos sobre el fenol fue Joseph Lister, entonces profesor de cirugía en la universidad de Glasgow. Las primeras publicaciones de su «cirugía antiséptica» aparecieron en la revista médica británica The Lancet en 1876 [Lister J. On a new method of treating compound fracture abscess, etc. With observations on the conditions of suppuration. Lancet 1864; 1: 387-9]
El fenol fue perdiendo preeminencia por su naturaleza corrosiva; solo se podía aplicar sobre la piel a muy bajas concentraciones. Hoy día solo está presente en algunas cremas antisépticas y enjuagues bucales.
Muy pronto se comenzaron a buscar derivados del fenol. Así, en 1867 Arthur Sansom, a la sazón en el London’s Royal Hospital for Diseases of the Chest, administró sulfocarbolato postásico en la creencia errónea de que, tras la administración oral, se descompondría liberando fenol que actuaría como un antiséptico en el organismo. En realidad se trataba de una mezcla de los tres isómeros ortho, metha y para (véase estructuras químicas). Se comercializó con el nombre de ácido solozico, llegando a prescribirse como tratamiento de la difteria, escarlatina y fiebre puerperal.
 El lado oscuro del fenol fue su utilización en los campos de exterminio nazis, así como durante el programa AKTION T4 para el asesinato de personas con discapacidad para lo que contó con la aquiescencia de prestigiosos médicos germanos, no solo aquellos que han pasado a la historia de la ignominia.
El lado oscuro del fenol fue su utilización en los campos de exterminio nazis, así como durante el programa AKTION T4 para el asesinato de personas con discapacidad para lo que contó con la aquiescencia de prestigiosos médicos germanos, no solo aquellos que han pasado a la historia de la ignominia.
Ácido salicílico.-
 Siguiendo las investigaciones sobre el fenol, Herman Kolbe (recuérdese la reacción homónima) trató fenol con dióxido de carbono en presencia de sodio. La reacción, bajo condiciones de presión elevada, daba lugar a ácido salicílico. Cuando se calentaba el ácido salicílico así obtenido se liberaba dióxido de carbono y un compuesto de carácter ácido que liberaba fenol. En condiciones clínicas el ácido salicílico no daba lugar a fenol; pero el ácido salicílico per se era también antiséptico, menos corrosivo que el propio fenol. De hecho se utilizó para quemar verrugas.
Siguiendo las investigaciones sobre el fenol, Herman Kolbe (recuérdese la reacción homónima) trató fenol con dióxido de carbono en presencia de sodio. La reacción, bajo condiciones de presión elevada, daba lugar a ácido salicílico. Cuando se calentaba el ácido salicílico así obtenido se liberaba dióxido de carbono y un compuesto de carácter ácido que liberaba fenol. En condiciones clínicas el ácido salicílico no daba lugar a fenol; pero el ácido salicílico per se era también antiséptico, menos corrosivo que el propio fenol. De hecho se utilizó para quemar verrugas.
Convencido de la utilidad práctica del ácido salicílico, Herman Kolbe adaptó su síntesis para que se pudiera llevar a cabo a escala industrial. Fue así como se creó en el año 1874 una fábrica en Dresde (Alemania) para la síntesis de ácido salicílico. Se trataba de la Salicylsäurefabrik del Dr. F. von Heyden.
Aun cuando el ácido salicílico nunca sustituyó al fenol en la práctica quirúrgica, llegó a popularizarse como antiséptico de uso interno. Era una época en que se daba por sentado que muchas enfermedades surgían por la diseminación de bacterias patógenas presentes en el tracto digestivo, muchas décadas antes de que se hablase de microbioma o microbiota. Por ejemplo, Carl Buss, en Suiza, administraba ácido salicílico per os a pacientes con fiebre tifoidea. Fue así como se descubrió que el ácido salicílico era mucho más eficaz como antipirético que como antiséptico sin que la disminución de la fiebre se debiese a la resolución de la infección.
Hacia 1875 Carl Buss añadió evidencias a la acción antitérmica del ácido acetil-salicílico, sin los importantes efectos adversos de la Quinina, por aquel entonces el tratamiento de elección de los cuadros febriles.
A través del empleo del ácido acetil-salicílico que Salomon Stricker hizo en Viena con objeto de controlar la fiebre en los procesos reumáticos, se descubrió su acción anti-reumática. Otros clínicos (Thomas MacLagan en Escocia, Germain Sée en Francia) confirmaron estos resultados. Sin embargo, ¡hasta mediados de la década de 1950! no se aceptó de modo generalizado que el ácido acetil-salicílico (Aspirina®) era un eficaz medicamento anti-reumático.
El ácido salicílico se formulaba como sal sódica (salicilato sódico). Los problemas iniciales tenían que ver con la escasa palatabilidad de las formulaciones y la irritación gástrica. Una estrategia para soslayar la irritación gástrica fue diseñada por el médico polaco Marceli Nencki en 1883: hizo reaccionar ácido salicílico con fenol formándose fenil-salicilato. Este compuesto atraviesa el antro gástrico sin degradación, debido a su insolubilidad. Una vez en el intestino se descompone en sus dos constituyentes. [Fenil-salicilato se comercializó con el nombre registrado de Salol®]. Las ventajas en relación al ácido salicílico se contrapesaban por un prolongado inicio de acción y una gran variabilidad de la respuesta terapéutica.
Aspirina.-
 Friedrich Bayer & Co., en Elberfeld inició una estrategia en 1896 para desvincularse de la dependencia de la investigación universitaria como fuente de potenciales nuevas moléculas con acción terapéutica. Como parte de esta estrategia, Arthur Eichengrün comenzó a sintetizar ésteres fenólicos en la esperanza que los sustituyentes (ésteres) enmascararan los efectos irritantes gástricos del ácido salicílico. Teóricamente los ésteres se hidrolizarían en el medio alcalino predominante en el duodeno, liberando el ácido salicílico que sería absorbido a la circulación sistémica.
Friedrich Bayer & Co., en Elberfeld inició una estrategia en 1896 para desvincularse de la dependencia de la investigación universitaria como fuente de potenciales nuevas moléculas con acción terapéutica. Como parte de esta estrategia, Arthur Eichengrün comenzó a sintetizar ésteres fenólicos en la esperanza que los sustituyentes (ésteres) enmascararan los efectos irritantes gástricos del ácido salicílico. Teóricamente los ésteres se hidrolizarían en el medio alcalino predominante en el duodeno, liberando el ácido salicílico que sería absorbido a la circulación sistémica.
Felix Hoffmann se involucró en la síntesis del ácido acetil-salicílico en forma pura (cristalizada). [Una versión del compuesto, menos purificada, ya se había sintetizado en 1896 por Heinrich Dreser].
Los primeros usos (no ensayos clínicos, sino entrega de la sustancia a diversos médicos para que la probasen en sus pacientes) demostraron que el ácido acetil-salicílico era notablemente más eficaz contra el dolor que el propio ácido salicílico
Los resultados comunicados por Arthur Eichengrün indujeron al laboratorio (F. Bayer & Co.) a realizar ensayos clínicos: uno dirigido por Kurt Witthauer en el Deaconess Hospital en Halle; y otro dirigido por Julius Wohlgemuth en Berlín.
 Los resultados de ambos estudios clínicos fueron determinantes para que el laboratorio comercializase el ácido acetil-salicílico con el nombre registrado de Aspirina®. El término aspirina fue acuñado por Arthur Eichengrün usando la letra “a” del prefijo acetil, y “spirin” de la planta Spirea ulmaria, denominación hoy obsoleta, de donde se extrajo la salicina.
Los resultados de ambos estudios clínicos fueron determinantes para que el laboratorio comercializase el ácido acetil-salicílico con el nombre registrado de Aspirina®. El término aspirina fue acuñado por Arthur Eichengrün usando la letra “a” del prefijo acetil, y “spirin” de la planta Spirea ulmaria, denominación hoy obsoleta, de donde se extrajo la salicina.
La Aspirina® fue el primer medicamento que fue objeto de una extensa campaña promocional: el laboratorio distribuyó más de 30.000 muestras entre los médicos.
Tras la llegada del Partido Nacional Socialista Alemán de los Trabajadores (el partido nazi) en 1933, se trató de desacreditar a Felix Hoffmann, por su ascendencia judía, como el químico que sintetizó el ácido acetil-salicílico, esto es, el descubridor de la Aspirina®.
Transcurrieron varias décadas antes de que se descifrase el mecanismo de acción del ácido acetil-salicílico. El misterio se desentrañó finalmente en el año 1971 cuando John R. Vane, entonces adscrito al Institute of Basic Medical Sciences de la universidad de Londres y del Royal College of Surgeon of England, demostró que inhibe la síntesis de prostaglandinas, mediante la transferencia del grupo acetilo del ácido acetil-salicílico al grupo hidroxilo de un aminoácido serina en la posición 70 del extremo C-terminal de la enzima ciclo-oxigenasa que cataliza la síntesis de las prostaglandinas. [John R. Vane ex aquo Sune K. Bergström y Bengt I. Samuelsson fueron galardonados con el Premio Nobel de Fisiología o Medicina por sus trabajos sobre las prostaglandinas y moléculas afines].
Otro efecto de la Aspirina® es su acción anti-agregación plaquetaria, debido también a la inhibición de la síntesis de prostaglandinas. En 1949, Gibson describió los resultados del empleo de ácido acetil-salicílico en un pequeño grupo de pacientes con problemas vasculares. Sus hallazgos, junto con los de Lawrence Craven en California confirmaban que los pacientes tratados con ácido acetil-salicílico por su acción antirreumática sufrían hemorragias con mayor frecuencia. Al mismo tiempo, Lawrence Craven observó durante un estudio no-controlado en más de 8.000 pacientes que usaban Aspirina® de modo regular, una bajísima incidencia de ataques cardíacos. La muerte por un ataque cardíaco del propio Lawrence Craven, un usuario regular de la Aspirina®, socavó la credibilidad de sus hallazgos.
Por suerte, Harvey Weiss estableció en 1967 en New York que la mayor incidencia de hemorragias entre quienes tomaban Aspirina® se debía a una disminución de la agregación plaquetaria. Pocos años después, en 1971, teorizó que la Aspirina® podía ser un magnífico medicamento anti-trombosis. Para confirmar esta teoría se llevó a cabo en Gales (Reino Unido) un ensayo al objeto de valorar la eficacia de la Aspirina® en la «prevención secundaria» (prevención de ataques cardíacos en pacientes con historia clínica previa de accidentes cardiovasculares). Diversos estudios y no poca controversia, han conducido a la aceptación de que dosis bajas de ácido acetil-salicílico son eficaces en la «prevención secundaria» de patología cardiovascular.
Análogos de la Aspirina®.-
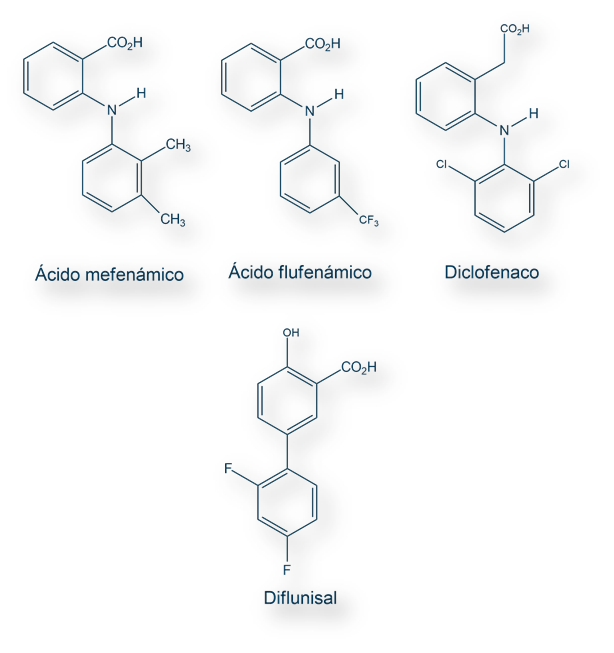 Nombres IUPAQ de las estructuras anteriores:
Nombres IUPAQ de las estructuras anteriores:
Ácido mefenámico:
Ácido N-(2,3-dimetilfenil)-2-aminobenzóico
Ácido flufenámico:
Ácido N-(3-trifluorometilfenil)-2-aminobenzóico
Diclofenaco:
Ácido 2-[2-(2,6-dicloroanilino)fenil]acético
Diflunisal:
Ácido 5-(2,4-difluorofenil)-2-hidroxibenzóico
El ácido antranílico (ortho-aminobenzóico) es un análogo del ácido salicílico en el que el sustituyente hidroxilo (−OH) de la estructura fenólica se ha reemplazado por un grupo amino (−NH2).
Parke Davis (laboratorio ya desparecido en la vorágine de fusiones y absorciones de empresas farmacéuticas) sintetizó el ácido mefenámico, añadiendo a la estructura química un segundo anillo de benceno que disminuía el pH al mismo tiempo que evitaba la formación de un ion tipo zwitter (zwitterion[i]). El ácido mefenámico se patento en el año 1961. A este le siguieron el ácido flufenámico (1948); y, más tarde, el diclofenaco desarrollado por los también desaparecidos laboratorios Geigy.
Merck Sharp & Dohme (la división europea de la estadounidense Merck & Co.) introdujo diflunisal. Fue el resultado de tres lustros de investigación en la búsqueda de un anti-inflamatorio de duración de acción prolongada pero que mantuviese la acción farmacológica de la Aspirina®.
Ácido p-amino-salicílico (PAS).-
 En 1940 Frederick Bernheim, a la sazón bioquímico de la universidad North Caroline (Estados Unidos) descubrió que cuando se añadían los ácidos benzoico y salicílico a los medios de cultivo de Mycobacterium tuberculosis, las bacterias consumían más oxígeno, indicativo de que ambos compuestos eran excelentes nutrientes para esta bacteria aerobia estricta. Bajo los modelos de la «teoría de los anti-metabolitos» (que tan importante fue en el desarrollo de los primeros medicamentos anticancerosos), Alfred Burger, junto a Bernheim estudiaron diversos ácidos aromáticos halogenados y éteres fenólicos como posibles anti-metabolitos que pudieran ser útiles como fármacos anti-tuberculosos.
En 1940 Frederick Bernheim, a la sazón bioquímico de la universidad North Caroline (Estados Unidos) descubrió que cuando se añadían los ácidos benzoico y salicílico a los medios de cultivo de Mycobacterium tuberculosis, las bacterias consumían más oxígeno, indicativo de que ambos compuestos eran excelentes nutrientes para esta bacteria aerobia estricta. Bajo los modelos de la «teoría de los anti-metabolitos» (que tan importante fue en el desarrollo de los primeros medicamentos anticancerosos), Alfred Burger, junto a Bernheim estudiaron diversos ácidos aromáticos halogenados y éteres fenólicos como posibles anti-metabolitos que pudieran ser útiles como fármacos anti-tuberculosos.
Algunos de los compuestos sintetizados (por ejemplo: ácido 2, 3, 5-triyodobenzoico) se mostraban muy activos, pero su toxicidad sobre el Sistema Nervioso Central imposibilitaba su uso clínico.
Frederick Bernheim comunicó sus hallazgos a Jorgen Lehmann del Sahlgren’s Hospital de Gotemburgo, Suecia. Durante su estudio con las recientemente descubiertas sufamidas (apócope de sulfanilamidas) se observó la importancia de la presencia de un sustituyente amino (−NH2). Así fue como se decidió añadir este radical al ácido salicílico bteniéndose un medicamento tuberculostático, el ácido para-amino-salicílico (más conocido por su acrónimo PAS).
El ácido p-amino-salicílico se estudió en animales en 1944 mostrando actividad anti-tuberculosa con relativamente pocos efectos adversos. Tras varios ensayos clínicos se confirmó que el ácido p-amino-salicílico era un eficaz fármaco contra el bacilo de Koch.
Enseguida se vio que el tratamiento contra la tuberculosis requería la administración simultánea de varios fármacos, siendo durante años la «triple terapia» (estreptomicina + isoniazida + PAS) el tratamiento de elección de la tuberculosis. Con la «triple terapia» se trataba de evitar la aparición de resistencias, sobre todo contra la estreptomicina.
Una particularidad del PAS es su rápida excreción renal, que exige la administración de dosis diarias de hasta 12g en cuatro tomas. Este hecho, junto con los efectos adversos gastrointestinales fue determinante para su exclusión de la terapéutica anti-tuberculosa a partir de la década de 1980.
Zaragoza a 6 de diciembre de 2021
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Farmacia Las Fuentes
Zaragoza
[i] Zwitterion: es una molécula con separación de cargas eléctricas (negativas y positivas) que se compensan de tal suerte que la molécula es eléctricamente neutra. Deriva del término alemán zwiter, traducible por neutro.


