Siguiendo la aprobación en Reino Unido de Molnupiravir de laboratorios Merck, y pocas horas después de la publicación del informe favorable de la European Medicine Agency recomendando su autorización en los países de la Unión Europea, la multinacional, también estadounidense, Pfizer ha dado a conocer su propio tratamiento antiviral contra el covid-19.
1,3-Tiazol-5-il-metil N-[(2S, 3S, 5S)-3-hidroxi-5[[(2S)-3-metil-2-[[ metil(2-propan-2—il-1,3-tiazol-4-il)metil] carbamoil]amino]butanoil]amino]-1,6-difenilhexan-2-il]carbamato
 Ritonavir es un péptido-mimético antirretroviral inhibidor de la enzima proteasa vírica prescrita de sólito para el control de la infección por VIH.
Ritonavir es un péptido-mimético antirretroviral inhibidor de la enzima proteasa vírica prescrita de sólito para el control de la infección por VIH.
Ritonavir puede causar una elevación transitoria y asintomática de los niveles en suero de la enzima amino-transferasa. Si un paciente con VIH y co-infección con virus de la hepatitis B o C recibe tratamiento con Ritonavir se puede producir un agravamiento de la hepatitis subyacente.
Ritonavir es un derivado del aminoácido L-valina, en el que el grupo α-amino ha sido acetilado por un grupo [(2-isopropil-1,3-tiazol-4-il)metil]metilcarbamoilo; y la sustitución de un átomo de hidrógeno del grupo carboxamido por un grupo (2R,4S,5S-4-hidroxi-1,6-difenil-5-[[(1,3-tiazol-5-il-metoxi)carbonil]amino]hexan-2-il (véase estructuras químicas bidimensionales).
Ritonavir se asocia con otros inhibidores de la proteasa; una de estas combinaciones es con Paritaprevir (asociación registrada como Viekira Pak®) para el tratamiento de la hepatitis C crónica genotipo-1.
Según el propio laboratorio (Pfizer) su preparado farmacéutico (PF-07321332 / Ritonavir) es incluso más eficaz que el de Merck (Molnupiravir) para prevenir el desarrollo de covid-19 grave si se administra tan pronto debuten los primeros síntomas. Se comercializará con el nombre registrado de Paxlovid®; y, según los informes preliminares, reduce el riesgo de hospitalización y muerte en aproximadamente un 89% cuando se administra en los 3 días siguientes a la aparición de los primeros síntomas. De hecho, Pfizer interrumpió el ensayo clínico en curso (EPIC-HR Study) en razón de los resultados favorables que hacía éticamente injustificable mantener un grupo placebo.
El tratamiento podría estar disponible en los próximos meses, pero los suministros se prevén limitados por razones logísticas.
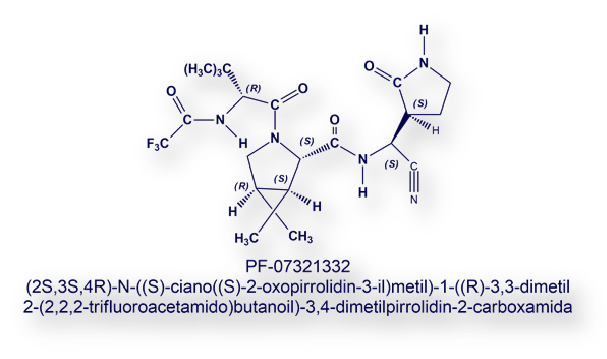
El fármaco de Pfizer (PF-07321332) se presentó en la American Chemical Spring 2021 Meeting. Su diana farmacológica es la proteasa 3CL del SARS-CoV-2. Para que el coronavirus se divida y forme nuevas partículas víricas (viriones) es necesario el clivaje de estas proteasas. PF-07321332 inhibe este proceso.
En 2020 Pfizer notificó también otra molécula designada PF-07-304814 que inhibía dos proteasas distintas a las que son diana farmacológica del actual fármaco de Pfizer. PF-07-304814 se desarrolló durante la epidemia del SARS del bienio 2002-2003. Este fármaco, a diferencia del actual, requería administración intravenosa en un entorno hospitalario.
PF-07321332 se ha desarrollado íntegramente durante la actual pandemia. Es un inhibidor covalente reversible de las proteasas víricas 3CL, uniéndose de modo específico a los residuos del aminoácido cisteína. En julio de 2020 se sintetizaron los primeros 7mg de la molécula; en octubre ya se disponía de 100g; y dos semanas más tarde de 1Kg. Una de las personas más involucradas en el proyecto que ha conducido al PF-07321332 es Ana Martínez, del CSIC (Consejo Superior Investigaciones Científicas) español.
Los antivirales de Merck y Pfizer se dirigen a pacientes de alto riesgo de sufrir un covid-19 grave, que incluyen a mayores de 60 años y/o patologías asociadas.
Dado que en países desarrollados la vacunación [anti-covid-19] es generalizada, estos tratamientos orales vendrían a sellar las brechas epidemiológicas por las que pueden surgir nuevos brotes infecciosos.
Tal como ha hecho con Merck, el gobierno federal estadounidense prevé adquirir dosis suficientes para 1,7 millones de tratamientos, ampliables hasta 3,3 millones. Se provisiona una cantidad suficiente para pagar alrededor de $700 por tratamiento, para los medicamentos [anti-covid-19] tanto de Merck como de Pfizer.
Otros países (Reino Unido y Australia) se han apresurado a establecer preacuerdos con Pfizer.
Siguiendo la práctica de Merck, también Pfizer ha llegado a acuerdos con organizaciones filantrópicas para suministrar su medicamento a países pobres en condiciones especialmente ventajosas.
Ambos medicamentos (de Merck y Pfizer) se toman por vía oral, siendo una notable ventaja en relación con los anticuerpos monoclonales (únicos tratamientos disponibles hasta ahora, pero que requieren la administración intravenosa en un hospital.
El tratamiento con PF-07321332 se ha de asociar con la administración de 6 dosis diarias durante 5 días de Ritonavir cuya función es inhibir el metabolismo del PF-07321332. [El tratamiento con Molnuparivir de laboratorios Merck requiere la administración de 40 dosis durante 5 días].
Hasta ahora, el fármaco de Pfizer se ha probado en pacientes de alto riesgo (mayores de 60 años, obesos, diabéticos o inmunodeprimidos), pero el laboratorio quiere ampliar la cobertura de tratamiento a personas que conviven con el infectado.
Los resultados de eficacia de PF-07321332 se obtuvieron mediante un estudio que incluía grupo placebo. Más de 1.200 pacientes participaron en el estudio. La selección de los candidatos del estudio se llevó a cabo entre julio y septiembre, cuando la variante delta (δ) predominaba en casi todas partes. Ninguno de los voluntarios había sido vacunado, circunstancia que aumentaba el riesgo de padecer una infección grave.
La eficacia (~89%) notificada por el laboratorio Pfizer se obtuvo del grupo de voluntarios que iniciaron el tratamiento en los tres días siguientes a la manifestación de los síntomas. Cuando se incluyeron a pacientes que comenzaron el tratamiento al 4º o 5º día desde la aparición de los síntomas, la eficacia (determinada por el riesgo de hospitalización y muerte) se redujo al 85% aproximadamente. En este sentido, el tratamiento de Merck (Molnupiravir) logró una eficacia no superior al 50% (inicio del tratamiento entre el día 0 y el 5º tras la aparición de los primeros síntomas). Sin embargo, los fármacos de Merck y Pfizer no son comparables por las diferencias en el diseño metodológico de los estudios.
Los tratamientos a base de anticuerpos monoclonales reducen las hospitalizaciones y fallecimientos en el 70% aproximadamente. Sin embargo, estos fármacos [anticuerpos monoclonales] son más costosos y requieren administración intravenosa en un hospital.
Con el tratamiento de Pfizer (PF-07321332) no se notificaron efectos adversos significativos, en cualquier caso mucho más leves que los de la propia infección.
Recordemos que Molnupiravir de laboratorios Merck opera dando lugar a mutaciones catastróficas en el código genético del virus. Esto ha generado inquietud acerca de la posibilidad de que también dé lugar a mutaciones en el ADN de las células humanas. Por esta razón, Molnupiravir está precautoriamente contraindicado en embarazadas y madres lactantes.
Zaragoza, a 11 de noviembre de 2021
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Farmacia Las Fuentes
Zaragoza