Katalin Karikó se crio en su Hungría natal. Su sueño de ser científica le llevó a emigrar a Estados Unidos a la edad de 20 años (ahora, año 2021, tiene 66). Durante años tuvo trabajos precarios, sin acceder a un puesto relativamente estable y adecuadamente remunerado. Sus estudios en colaboración con Drew Weissman de la universidad de Pensilvania sentaron las bases teóricas que han hecho factible las vacunas anti-covid-19 de los laboratorios Pfizer-BioNTech y Moderna Therapeutics.
Su investigación se centró en el ARN mensajero (un transcrito del ADN que codifica la síntesis de proteínas), en la convicción de que este trascendente ácido nucleico se podría inyectar en las células para que fabricasen medicamentos e incluso vacunas.
Sus proyectos se consideraron poco viables, obligándole a pasar de un centro de investigación a otro buscando mentores. A pesar de los contratiempos profesionales (nunca tuvo emolumentos acordes con sus trabajos), su entusiasmo por la investigación científica no decayó Es el precio que han de pagar quienes persiguen ideas que contravienen los convencionalismos científicos. Las ideas de Katalin Karikó sobre el ARN eran heterodoxas en su época.
Nadie podía prever que esas investigaciones harían posible las primeras vacunas contra la pandemia covid-19, desbrozando la senda para otras potenciales vacunas contra otras enfermedades, desde la gripe a la malaria.
Durante la primera parte de su vida vivió en Kisujszallas, una pequeña ciudad de provincias en Hungría, doctorándose en la universidad de Szeged, trabajando con posterioridad en el Centro de Investigación Biológica.
En 1985, cuando el programa de investigación se quedó sin fondos (el colapso del gobierno comunista era inminente), Katalin Karikó, su esposo y su hija de 2 años emigraron a Filadelfia, Estados Unidos, trabajando como estudiante post-doctoral en la universidad de Temple. Como el gobierno húngaro no permitía sacar del país más de $100 (aproximadamente 80€), cosieron 900 libras esterlinas (alrededor de 1.000€)- todos sus ahorros – en un osito de peluche de su hija, Susan, quien andando el tiempo se convirtió en ganadora por dos veces de la medalla olímpica de remo.
 Se interesó (se apasionó sería más adecuado) por el ARN, mensajero en una época en que se ignoraba casi todo sobre esta molécula más allá de su papel de intermediaria entre los genes (el conjunto del ADN) y las proteínas. Entonces parecía imposible sintetizar incluso pequeñas moléculas de ARN en un laboratorio; y, aun menos introducirlas en el interior de las células para que se tradujesen en proteínas.
Se interesó (se apasionó sería más adecuado) por el ARN, mensajero en una época en que se ignoraba casi todo sobre esta molécula más allá de su papel de intermediaria entre los genes (el conjunto del ADN) y las proteínas. Entonces parecía imposible sintetizar incluso pequeñas moléculas de ARN en un laboratorio; y, aun menos introducirlas en el interior de las células para que se tradujesen en proteínas.
En 1989 comenzó a trabajar con Elliot Barnathan, cardiólogo de la universidad de Pensilvania, asistente de investigación y, en consecuencia, sin acceso a las subvenciones necesarias para llevar a cabo ambiciosos programas de investigación.
Con precariedad financiera Elliot Barnathan y Katalin Karikó proyectaron insertar moléculas de ARN mensajero en el interior de las células, en la esperanza de que se tradujeran en proteínas. La primera proteína que querían obtener era el receptor de la uroquinasa. [La uroquinasa es una proteína descubierta en el año 1947 por McFarlane y Pilling]. El éxito de la investigación dependía de que la proteína así sintetizada se engarzase a su receptor fisiológico. Tras muchas pruebas fallidas, al final llegó el éxito: el ARN introducido en una célula en cultivo (in vitro) codificaba la proteína. El hallazgo era de enorme trascendencia: teóricamente las células podían sintetizar cualquier proteína insertando el ARN mensajero correspondiente. Las aplicaciones clínicas de este hallazgo solo parecían tener un techo: la imaginación de los propios investigadores.
La verdadera valía de la investigación no es realizar experimentos que confirmen las teorías, sino que pueden contradecirlas, aceptando modestamente sus resultados. Los fracasos son siempre (o casi) la antesala del éxito.
Una de las primeras potenciales aplicaciones de la nueva técnica era tratar a pacientes que desarrollaban coágulos tras cirugía cerebral al objeto de prevenir los potenciales ictus. Trataban de que las células sintetizasen una proteína necesaria para la acción del óxido nítrico. una sustancia que causa vasodilatación, pero solo durante una fracción de segundo (milisegundos). Esta sustancia no se puede inyectar. Todos los experimentos realizados fracasaron; y el grupo de trabajo perdió la financiación. La investigación sobre las aplicaciones del ARN mensajero se estancó.
Fue entonces cuando inició la colaboración con Drew Weissman. Proyectaban desarrollar una vacuna contra la infección por VIH (Virus de Inmunodeficiencia Humana, causante del SIDA).
Hasta entonces los experimentos con ARN se habían llevado a cabo en células in vitro (en cultivo). En ese entorno el ARN mensajero parecía funcionar, pero no cuando se inyectaba en animales de experimentación (roedores). De hecho los ratones a los que se inyectaba el ARN mensajero enfermaban: su pelaje se alteraba, se encorvaban y dejaban de comer. Pronto se descubrió que el ARN foráneo actuaba como un antígeno que desencadenaba una intensa respuesta inmune en los ratones. No parecía haber una explicación, dado que el ARN inyectado era idéntico al fabricado por las propias células del animal. ¿Qué los hacía distintos?
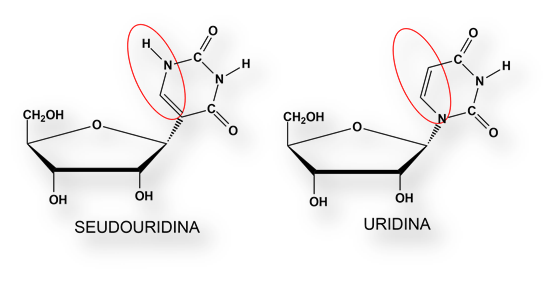 Observaron que el ARN mensajero causa esa reacción inmune, pero no otro tipo de ARN (ARN de transferencia) al que se une los aminoácidos que se insertan en la cadena proteica en formación siguiendo el patrón del ARN mensajero. La respuesta de esta diferencia radica en un nucleótido, la pseudouridina, presente en el ARN de transferencia pero no en el ARN mensajero. En esta mínima diferencia se halla la clave para la tolerancia del sistema inmune al ARN mensajero inyectado.
Observaron que el ARN mensajero causa esa reacción inmune, pero no otro tipo de ARN (ARN de transferencia) al que se une los aminoácidos que se insertan en la cadena proteica en formación siguiendo el patrón del ARN mensajero. La respuesta de esta diferencia radica en un nucleótido, la pseudouridina, presente en el ARN de transferencia pero no en el ARN mensajero. En esta mínima diferencia se halla la clave para la tolerancia del sistema inmune al ARN mensajero inyectado.
La simple adición de seudouridina al ARN mensajero lo protegía frente al sistema inmune. Hela aquí, la clave para que se pudiera inyectar ARN mensajero en las células sin desencadenar una potente respuesta inmunológica. En aquel momento, nadie vio las implicaciones del descubrimiento. No se anticipaba qué utilidad podría tener la inyección de ARN mensajero.
Todavía más: muchas revistas médicas de prestigio rechazaron la publicación de la investigación. Cuando finalmente apareció en Immunity, el trabajo apenas despertó interés en el ámbito científico.
Weissman y Karikó continuaron sus investigaciones: inyectaron en monos ARN mensajero que actúa como molde para la síntesis de una trascendente proteína (eritropoyetina) que estimula la síntesis de hematíes. Se podía inferir que, siguiendo esta metodología, se podría fabricar casi cualquier proteína (insulina por ejemplo); y, ¿por qué no, también vacunas? Teorizando, se podría inyectar el ARN mensajero que codificase alguna proteína vírica imprescindible para desencadenar la infección, en lugar del virus completo atenuado.
Tras ser rechazados por muchas empresas, Moderna Therapeutics (Estados Unidos) y BioNTech (Alemania) se interesaron por el potencial de los hallazgos de Drew Weissman y Katalin Karikó. [La multinacional estadounidense Pfizer se asoció con la biotecnológica alemana BioNTech].
Los primeros ensayos clínicos de una potencial vacuna basada en ARN mensajero se dirigieron hacia la gripe estacional, el citomegalovirus y el virus Zika. Luego llegó el coronavirus SARS-CoV-2.
Desde su descripción por June Almeida se sabía que los coronavirus son esferoides tachonados de proteína a modo de espinas que posibilitan la entrada en las células que infectan.
Los primeros días de 2020, cuando solo existía una poco definida preocupación por una inusual neumonía entre algunos ciudadanos de la ciudad china de Wuhan (provincia de Hubei) se publicó online la secuencia completa del nuevo coronavirus responsable.
Partiendo de los conocimientos, BioNTech y Moderna Therapeutics modelizaron sus vacunas en pocos días. Luego vendría el problema de perfeccionar la formulación y estudiarla, primero en animales experimentales, más tarde en ensayos clínicos en humanos.
Conceptualmente, ambas vacunas están elaboradas para introducir el ARN mensajero de la proteína que sobresale del esferoide vírico. De ahí que a esta proteína se le denomine S (del inglés, Spike, espiga o espícula). La proteína S aislada actuaría como un antígeno que estimularía al organismo a sintetizar anticuerpos específicos, reaccionando de manera rápida y contundente ante la infección por el coronavirus completo.
La formulación galénica de la vacuna era compleja: el ARN mensajero no se puede inyectar directamente. Necesita ser encapsulado en una burbuja de lípidos (liposoma) que lo vehiculice al interior de las células. Por fortuna los liposomas ya se habían desarrollado, fundamentalmente por el grupo de trabajo de Pieter Cullis, de la universidad de la Columbia Británica, en Canadá.
Otra notable dificultad era aislar la proteína S del coronavirus, problema que Barney Graham de los National Institutes of Health, y Jason McClellan, de la universidad de Texas, resolvieron en muy poco tiempo.
Pfizer publicó los resultados preliminares de los ensayos clínicos en humanos el 8 de noviembre (2020). De hecho, Drew Weissman Katalin Karikó se hallaban entre las primeras personas vacunadas.
Zaragoza, a 10 de abril de 2021
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Farmacia Las Fuentes
Zaragoza

