XYREM® Y XYWAY®, NUEVOS TRATAMIENTOS PARA LA NARCOLEPSIA
Xyrem®; y Xyway® (formulación con bajo contenido en Na+)
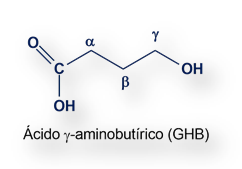 Durante la década de 1960, el ácido ꝩ-hidroxibutírico, más conocido por su acrónimo GHB) se usó para amortiguar el estado de conciencia de mujeres parturientas. [Preliminary Experiences with the Clinical Use of Sodium 4-Hydroxybutirate in Anesthesia for Obstetrics and Gynecology].
Durante la década de 1960, el ácido ꝩ-hidroxibutírico, más conocido por su acrónimo GHB) se usó para amortiguar el estado de conciencia de mujeres parturientas. [Preliminary Experiences with the Clinical Use of Sodium 4-Hydroxybutirate in Anesthesia for Obstetrics and Gynecology].
En la década de 1990 y primeros años del presente siglo esta misma sustancia se empleó de modo ilícito en agresiones sexuales y violaciones.
Y durante las primeras dos décadas del siglo XXI, una formulación galénica líquida (suspensión) de diversas sales (ꝩ-hidroxibutiratos de sodio, potasio, calcio y magnesio) se estudió como potencial tratamiento de la narcolepsia (hiperinsomnio idiopático), un trastorno neurológico que cursa con repentinos e incontrolables ataques de sueño durante las horas de vigilia.
La Food and Drug Administration (FDA) estadounidense ha autorizado en fechas muy recientes la comercialización del medicamento con el nombre registrado de Xyway®. Es el primer fármaco aprobado específicamente para el tratamiento de esta enfermedad. Xyway® es comercializado por Jazz Pharmceuticals.
Algunos expertos declaran que la evidencia disponible sobre la eficacia de este nuevo fármaco es débil. El medicamento actúa desencadenando un profundo sueño reparador; y lo consigue con tanta rapidez que la información técnica aconseja que se tome cuando se está acostado. Una versión anterior de Xyway®, denominada Xyrem®, con elevado contenido de sal (cloruro sódico), mostró efectos adversos graves, incluyendo problemas respiratorios, ansiedad, depresión, sonambulismo, alucinaciones e ideaciones suicidas.
Además, esta sustancia (GHB) tiene potencial de abuso y adicción.
El hiperinsomnio idiopático (narcolepsia) es una enfermedad infrecuente, que suele coexistir con otras alteraciones clínicas.
Se trata de un trastorno neurológico del sueño que cursa con debilidad asociada a somnolencia diurna, incapacidad de mantenerse despierto y alerta durante el día, junto a períodos de sueño irreprimible. El sueño nocturno suele ser prolongado (hasta 11 horas); el deterioro cognitivo, las siestas no-reparadoras, y confusión, irritabilidad son algunos de los síntomas. Esta patología, infra-diagnosticada, interfiere con las actividades sociales, educativas y laborales.
La venta de Xyrem® y Xyway® supuso para el laboratorio, Jazz Pharmaceuticals, con sede en Dublín, Irlanda, unos beneficios de más de 1.700 millones de dólares, derivados del tratamiento de alrededor de 15.300 personas, todas con diagnóstico clínico de narcolepsia (hiperinsomnio idiopático).
En el mercado negro, el GHB, también conocido con éxtasis líquido, sustancia pegajosa (goop) y G, se puede adquirir por entre $5 y $25. Sin embargo los tratamientos con Xyrem® y Xyway® tienen un coste de $100,000 (cien mil dólares) anuales.
Sin duda alguna, la aprobación del fármaco por la FDA ha estado condicionada por tratarse del primer medicamento específico para esta patología.
El hiperinsomnio idiopático (narcolepsia) es un trastorno incurable que necesita tratamiento de por vida.
En el mes de marzo (2021) Jazz and the Hypersommia Foundation, un grupo de apoyo a pacientes, inició una campaña de concienciación, tanto entre la población general como entre los médicos prescriptores.
El GHB es un fármaco antiguo. Fue sintetizado por primera vez en 1874 por un químico ruso. Más tarde se vendía en Estados Unidos como suplemento dietético. La investigación académica dio cuenta de que GHB mejoraba el patrón de sueño nocturno en personas afectadas de narcolepsia y frenaba sus ataques diurnos paralizantes (cataplejía).
En el año 1994, la Food and Drug Administration (FDA) estadounidense contactó con un laboratorio (Orphan Medical) para la investigación del GHB como posible tratamiento de la narcolepsia. El gobierno [de Estados Unidos] ofrece incentivos, incluidos créditos fiscales y siete años de exclusividad de mercado para el desarrollo de medicamentos destinados a patologías muy poco comunes.
Al mismo tiempo, GHB se estaba convirtiendo en un problema por su utilización ilícita. A dosis bajas, el polvo, inodoro, puede desencadenar euforia y excitación sexual, haciéndose relativamente popular en fiestas y raves (reuniones de días de duración con abundante consumo de sustancias ilícitas). Cuando GHB se mezcla con alcohol puede dar lugar a pérdida de conciencia, haciendo que la persona sea incapaz de recordar lo sucedido.
En el año 2000, el Congreso [estadounidense] prohibió el uso de la sustancia, tras varios casos de agresiones sexuales y muertes, pero permitió su investigación para potenciales usos médicos. Ese mismo año, Orphan Medical solicitó autorización a la FDA de Xyrem® para el tratamiento de la narcolepsia.
La FDA comenzó a recopilar testimonios contradictorios de pacientes que habían usado GHB con fines diversos, desde el control de la cataplejía (caída súbita en un sueño profundo durante el día), hasta suplemento para el culturismo.
El comité asesor [de la FDA estadounidense] recomendó la aprobación de Xyrem® para la narcolepsia con cataplejía. La autorización se produjo en el año 2002. Tres años después (2005) Jazz Pharmaceuticals adquirió Orphan Medical.
Xyrem® tiene un contenido elevado de sal (cloruro sódico), un grave problema para pacientes hipertensos. La nueva formulación galénica (Xyway®) se autorizó en 2020 con idéntica indicación terapéutica, pero con reducido contenido de sodio. Además los derechos de patente de Xyrem® terminarán en 2022, mientras Xyway® mantendrá sus derechos de venta en exclusividad hasta el año 2027.
Las recetas de ambos fármacos (Xyrem® y Xyway®) se controlan [en Estados Unidos] mediante el programa REM. (Risk Evaluation and Mitigation Strategies). Las farmacias seleccionadas envían el medicamento a sus pacientes y registran los potenciales efectos adversos, informando al laboratorio (Jazz Pharmaceuticals) que, a su vez, está obligado a remitir dicha información a la FDA (Food and Drug Administration).
A 30 de junio (2021) la FDA había registrado más de 27.000 efectos adversos graves, incluidos 753 fallecimientos. Sin embargo, no en todos los casos existe una relación causal inequívoca. Existen dudas acerca de la relación beneficios versus riesgos tanto de Xyrem® como de Xyway®.
En los primeros años de comercialización de Xyrem® para el control de la narcolepsia, Orphan Medical (más tarde adquirida por Jazz Pharmaceuticals) tuvo que asumir multas por más de 20 millones de dólares por promocionar el fármaco en indicaciones no autorizadas, tales como insomnio, depresión y fibromialgia.
De hecho, en 2010, Jazz Pharmaceuticals solicitó a la FDA la aprobación en la indicación de fibromialgia. Sin embargo, el comité asesor [de la FDA] votó mayoritariamente en contra. El número de pacientes con diagnóstico de fibromialgia es cada día más elevado y los riesgos de la autorización para esta indicación se consideraron inaceptables.
La FDA aprobó la indicación actual (hiperinsomnio idiopático o narcolepsia) sin la intervención de ningún comité asesor (una situación excepcional). Se fundamentó en un modesto ensayo clínico cruzado[1] realizado por Jazz Pharmaceuticals que involucró a 115 pacientes monitorizados durante 12 a 16 semanas. Se observó una disminución de la somnolencia en relación al grupo placebo, con suficiente validez estadística.
Sin embargo, el ensayo clínico está sesgado porque a los participantes se les permitió continuar sus tratamientos con medicamentos estimulantes, tanto en el grupo de estudio como en el grupo placebo.
A pesar de la polémica, muchos pacientes manifiestan haber obtenido mejorías que les compensan los potenciales graves efectos adversos.
Zaragoza a 1 de septiembre de 2021
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Farmacia Las Fuentes
Zaragoza
[1] Ensayo clínico cruzado: los participantes del grupo de estudio, se cambian al grupo placebo, valorándose las consecuencias.

