Remdesivir, de Gilead Sciences, se diseñó como medicamento antiviral para el tratamiento de la hepatitis e infecciones del tracto respiratorio. Tras los primeros estudios clínicos, Remdesivir se mostró poco eficaz en estas enfermedades, y al igual que sucede con muchos prometedores fármacos pronto entró a formar parte del arcón de los trastos farmacéuticos inútiles.
Curiosamente, el viernes, 1 de mayo (2020) la Food and Drug Administration (FDA) estadounidense autorizó bajo criterio PMA[1] este medicamento para el tratamiento de los enfermos graves infectados con coronavirus SARS-Covid-2 (o Covid-19, como también se le designa).
Este caso es paradigmático de que la investigación en causas perdidas (sin resultados financieros previsibles) tiene, en ocasiones, inesperadas sorpresas. Este ha sido el caso del trabajo de Mark Denison, a la sazón director de la unidad infecciosa pediátrica del hospital adscrito a la universidad de Vanderbilt, en Nashville, Tennessee, Estados Unidos. Comenzó a estudiar los coronavirus hace ahora un cuarto de siglo. En aquella época, los coronavirus, descubiertos durante la década de 1960, causaban poco más que resfriados comunes (infecciones de las vías respiratorias altas). El interés por los coronavirus se ceñía a la investigación básica, no clínica. En aquellos años nadie sospechó que otro coronavirus desencadenaría la peor crisis sanitaria desde la erróneamente denominada «gripe española» hace casi exactamente un siglo.
Un estudio financiado por el National Institute of Allergy and Infectious Diseases se llevó a cabo con máxima urgencia en 1.000 pacientes graves, hallando que el grupo de estudio )tratado con Remdesivir) se recuperó en 11 días (valor promedio), mientras el grupo control (con el tratamiento habitual pero sin Remdesivir) tardó un promedio de 15 días. Con este único aval, la FDA estadounidense autorizó la prescripción de Remdesivir en pacientes gravemente enfermos, bajo criterio de emergencia sanitaria.
Sin embargo, Remdesivir no redujo significativamente la mortalidad. Algunos críticos hicieron hincapié en que el criterio del estudio (end-point) se modificó focalizándolo en el tiempo de recuperación para, de ese modo, facilitar la autorización del medicamento. Por otra parte, los resultados del estudio no se sometieron a análisis estadístico. Parece como si la urgencia permitiese todo, incluso que las decisiones políticas se inmiscuyan en los posicionamientos científicos.
La aprobación para la prescripción de Remdesivir es temporal (mientras dure la actual pandemia) y condicionada (solo para pacientes gravemente enfermos). La autorización definitiva conlleva un procedimiento mucho más complejo y largo.
Los coronavirus tienen mucho más ARN (ácido ribonucleico) del que los virólogos pensaban que podía albergar cualquier virus. Son, de hecho, el segundo tipo con los ARN más largos de cuantos se han descubierto. La variabilidad génica asociada a mutaciones, inserciones y deleciones aumenta teóricamente cuánto más larga es la molécula de ácido nucleico. Curiosamente, los coronavirus, a pesar del gran tamaño de su ARN, no experimentan demasiadas mutaciones. En esta circunstancia radica su fortaleza [como patógenos], ya que las mutaciones suelen disminuir la virulencia. Los virus disponen de la estrategia para corregir los errores durante la replicación de su ácido nucleico (ARN o ADN). Aquellos con ácidos nucleicos de mayor tamaño contienen genes que codifican proteínas especializadas en la corrección de los errores durante la replicación.
Bajo las consideraciones del párrafo previo, la investigación se dirigió a la búsqueda de medicamentos que pudieran bloquear el sistema de corrección genético de los propios virus. Conceptualmente se lograrían dos efectos: las versiones mutantes del virus perderían virulencia; y la replicación se interrumpiría prematuramente dando lugar a partículas víricas no viables.
Mecanismo de acción.-
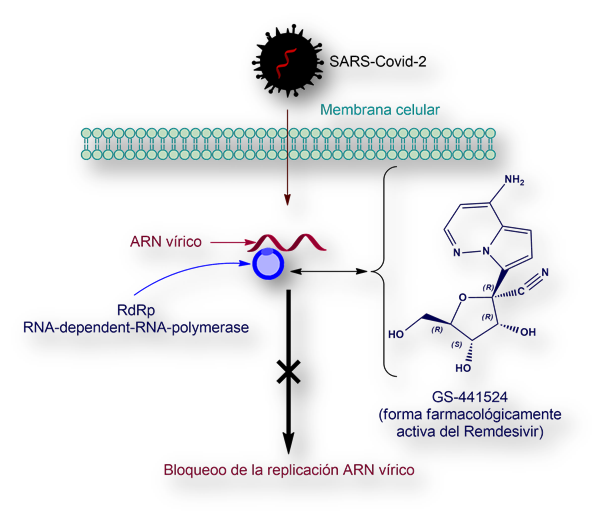
Una vez que el virus (SARS-Covid-2) penetra por invaginación en la célula, libera su ARN, el cual comienza a replicarse y transcribirse. La enzima RdRp (acrónimo de RNA-dependent-RNA-polymerase) cataliza la replicación. La forma activada (GS-441524) del fármaco Remdesivir se engarza con esta enzima RdRp bloqueando la replicación del ARN y el subsiguiente ensamblaje de nuevas partículas víricas infecciosas.
Gilead Sciences había diseñado numerosas moléculas con esta potencialidad. Por razones nunca explicadas, la línea de investigación se clausuró y las moléculas desarrolladas se archivaron.
Una de estas moléculas, con la designación preclínica GS-5734, fue Remdesivir. El efecto observado in vitro lo convertía en un prometedor fármaco antiviral. Se observaba en estudios de laboratorio que Remdesivir se intercalaba en el ARN vírico, bloqueando los mecanismos de corrección genética durante la replicación
En las pruebas iniciales, Remdesivir se mostró eficaz (in vitro) contra todos los coronavirus catalogados. En una etapa posterior de investigación, el medicamento logró resultados prometedores en animales infectados experimentalmente.
Tristemente las expectativas con el fármaco no se cumplieron cuando se probó en pacientes con hepatitis, así como durante la epidemia del virus ébola que afectó a varios países del occidente africano en el año 2014.
Al no hallarse indicación alguna para Remdesivir, el medicamento languideció en el trastero de moléculas fallidas. Sin embargo, todo cambió (o así parece) con la actual pandemia por el coronavirus SARS-Covid-2. Ante la falta de tratamientos farmacológicos, Remdesivir se consideró una opción, máxime teniendo en cuenta que ya se había estudiado in vitro, in vivo (animales de experimentación) y anecdóticamente en pacientes humanos con hepatitis e infecciones respiratorias leves causadas por coronavirus.
Los médicos comenzaron a prescribirlo al margen de los estudios clínicos. El propio uso, y los medios de comunicación, alimentaron la demanda. El laboratorio patrocinó algunos estudios (no todos metodológicamente rigurosos) e incluso entregó envases a médicos que lo usasen bajo criterio de «uso compasivo»[2].
No obstante, el estudio antes comentado es el único válido que justifica el empleo del medicamento, con el que, como se ha escrito antes, se reduce el tiempo de recuperación, pero carece de efecto discernible sobre la mortalidad. Hay que tener en cuenta que la gravedad de la infección Covid-19 no se debe tanto a la propia infección, sino a una respuesta inmunitaria desproporcionada que termina por hacer fracasar la función de múltiples órganos (fallo multiorgánico).
No todos están convencidos de la utilidad clínica de Remdesivir. Un estudio realizado en la República Popular China, a cuyo gobierno Gilead Sciences envío gratuitamente una gran cantidad de envases del fármaco, publicado en la revista médica británica The Lancet no encontró beneficio objetivo del tratamiento en pacientes gravemente enfermos. Otros se muestran reticentes con el estudio llevado a cabo en Estados Unidos, ya que solo se han hecho públicos los resultados, pero no el trabajo íntegro.
Gilead Sciences ha fabricado un millón y medio de viales de Remdesivir, suficientes para el tratamiento de aproximadamente 150.000 pacientes. El laboratorio los entrega sin coste alguno. Sin embargo, si finalmente Remdesivir se autoriza formalmente, su coste se prevé elevado, aun cuando su investigación fue financiada por el gobierno federal [de Estados Unidos].
Zaragoza, a 8 de mayo de 2020
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Farmacia Las Fuentes
Florentino Ballesteros, 11-13
50002 Zaragoza
[1] PMA: Premarket Approval for Medical Devices.
[2] «Uso compasivo»: prescripción de medicamentos para indicaciones no autorizadas.