Los actinomicetos son microorganismos del suelo con características intermedias entre las bacterias y los hongos. Su importancia va mucho más allá de la regulación del humus[1] que contribuye a la fertilidad del suelo. De los actinomicetos se han obtenido moléculas antibióticas fundamentales. Bien merecen un reconocimiento por el beneficio que aportan a la salud humana.
Alrededor del año 1917, Greig Smith[2] observó que actinomicetos del suelo de Nueva Gales del Sur (Australia) segregaban sustancias que impedían el crecimiento de determinadas bacterias. Algunos años después (1921), Rudolf Lieske[3] concretó algo más: algunos actinomicetos lisaban Staphilococcus aureus y Streptococcus pyogenes, pero no otras bacterias; tenían, pues, una acción antibiótica selectiva.
Un trabajo publicado en el año 1925 realizado por el grupo dirigido por André Gratia[4] en el Instituto Pasteur de Bruselas describía cómo varias especies de Streptothrix y Actinomyces se usaban en el laboratorio para lisar bacterias en cultivo (in vitro) con el fin de obtener antígenos. Los mucolisados así obtenidos (conteniendo antígenos de las bacterias muertas) se administraban a pacientes para desencadenar la síntesis y secreción de anticuerpos específicos contra las bacterias lisadas. Los experimentos, conceptualmente interesantes, no dieron los resultados esperados.
Maurice Welsch (Rockefeller Institute) denominó actinomicetina a la fracción proteica soluble del mucosilado.
Durante un viaje en trasatlántico a Estados Unidos Rene Jules Dubos conoció a Selman Abraham Waskam, a la sazón director del Departamento de Microbiología de la New Yersey Agricultural Experimental Station, adscrita a la universidad de Rutgers. [S.A. Waksman, judío de origen ucraniano, recibió el Premio Nobel de Fisiología y Medicina en 1952 por el descubrimiento de la Estreptomicina, el primer antibiótico frente a la tuberculosis]. Al llegar a New York, Rene J. Dubos se incorporó al equipo de Waskman instalándose en Estados Unidos durante más de medio siglo. Ambos compartían el convencimiento de que los microorganismos del suelo serían una fuente de moléculas antibióticas.
El papel jugado por René Jules Dubos no se ha valorado suficientemente. Sus trabajos sobre enzimología sentaron las bases para el desarrollo de los antibióticos. En el año 1939 extrajo de Bacillus brevis una sustancia antibacteriana a la que denominó tirotricina. No se trataba de una enzima sencilla, sino que contenía dos antibióticos: tirocidina y gramicidina. La gramicidina solo se formula en preparaciones galénicas de uso tópico, ya que cuando se estudió para empleo sistémico evidenció que causaba hemolisis. Fue el primer antibiótico usado en clínica. Dubos siempre siguió el consejo que le dio Oswald Avery: hay que mostrarse atrevido en la formulación de hipótesis y humilde en presencia de los hechos. [Recordemos que Oswald Avery, a partir de estudios con los neumococos, descubrió en 1944 que el ADN era la molécula que sustentaba la herencia de los caracteres adquiridos. Hasta su hallazgo se pensaba que la herencia se codificaba en las histonas, las proteínas presentes en el núcleo celular que empaquetan el ADN. Este descubrimiento hizo posible la formulación de la estructura de los ácidos nucleicos y la transferencia de información genética de James Dewey Watson y Francis Harry Compton Crick en la década siguiente. J. Watson, F. Crick ex aequo Maurice Hugh Frederick Wilkins recibieron el Premio Nobel de Fisiología y Medicina en el año 1962.
El grupo de trabajo [de Waksman] consiguió aislar de Actinomyces antibioticus la actinomicina-A[5], el primer antibiótico aislado de un actinomiceto. Tras exhaustivos estudios, la mayoría realizados en laboratorios Merck, la actinomicina-A se consideró demasiado tóxica para su empleo en terapéutica humana.
A pesar de este aparente primer fracaso, el grupo de Waskman recibió sumas millonarias (Commonwealth Fund, Albert & Mary Lasker Foundation, por citar las dos aportaciones más importantes) al objeto de continuar sus proyectos. La industria farmacéutica, siempre al quite, vio la potencialidad económica de tales investigaciones.
Waksman y sus colegas aislaron en 1941 otras dos moléculas antibióticas: clavacina (patulina) y fumigatina[6]. Aun cuando eran menos tóxicas que la actinomicina-A, seguían siendo inadecuadas para su empleo en clínica humana.
Durante la primera mitad de la década de 1940, el refugiado alemán Ernst Chain y el británico Howard Florey retomaron una molécula, aislada (y desechada) por Alexander Fleming tras su aislamiento fortuito dos décadas antes. Se trataba de la penicilina. Este antibiótico se mostró muy efectivo contra las bacterias Gram positivas. Además, era una molécula atóxica.
[Ernst Boris Chain ex aqueo Howard Walter Florey y Alexander Fleming fueron galardonados con el Premio Nobel de Fisiología y Medicina en el año 1945 por el descubrimiento de la Penicilina].
Haciendo virtud de la necesidad, Selman Abraham Waksman recondujo su línea de investigación hacia las moléculas activas contra las infecciones causadas por bacterias Gram negativas. Su perseverancia condujo a la estreptotricina, una molécula que se mostraba eficaz frente a las bacterias resistentes a la penicilina. Se invirtió mucho dinero en la investigación preclínica de la estreptotricina. Tristemente, cuando se inyectaba en animales de experimentación desencadenaba al cabo de varios días un cuadro clínico muy grave de insuficiencia renal que derivaba en fallo renal. La estreptotricina pasó a la historia de lo que pudo ser y no fue.
A partir de 1943, Selman Waksman y sus colaboradores redirigieron su línea de investigación hacia potenciales medicamentos contra la tuberculosis, una enfermedad infecciosa que mataba a millones de personas cada año. El primer problema con que se encontraron fue el lento crecimiento en cultivo del germen causal, Mycobacterium tuberculosis. Para solventar este traspiés, usaron en su lugar otra micobacteria no patógena (Mycobacterium phlei). Una ingeniosa estratagema consistía en enriquecer muestras del suelo rico en actinomicetos con Mycobacterium tuberculosis, con el fin de inducir la síntesis por los actinomicetos de potenciales sustancias contra la micobacteria tuberculosa. La tenacidad condujo al éxito: en septiembre de 1943 el equipo dirigido por Waksman aisló de una cepa de Streptomyces griseus[7] una molécula activa frente a Mycobacterium tuberculosis.
 La nueva molécula antibiótica era estreptomcina[8]. Su estructura química se desentrañó en 1947[9]. Aun cuando se relacionaba químicamente con la estreptotricina, no mostraba la toxicidad renal de esta última en animales de experimentación. Además, su espectro antibacteriano no se ceñía a la tuberculosis, siendo activa frente al bacilo de la peste (Yersinia pestis), brucelosis («fiebre de Malta») y varias formas de disentería. La estreptomicina tiene estructura de aminoglucósido. Su mecanismo de acción (extrapolable a todos los antibióticos con estructura de aminoglucósido es la siguiente: interferencia con la síntesis proteica bacteriana, más específicamente con proteínas de la unidad ribosómica [bacteriana] 30S[10] Ello trasunta en la traducción errónea del ARNM. Durante el proceso de traducción (ARNM ® proteína) se incorporan aminoácidos erróneos en la cadena proteica en crecimiento. Sin embargo, incluso la síntesis de proteínas incorrectas puede ser insuficiente para lograr una acción bactericida. También se ha teorizado que los antibióticos aminoglucósidos causan el desacoplamiento del ribosoma-ARNM re-acoplándose en presencia del antibiótico para formarse un complejo de iniciación anormal. La acumulación de estos complejos de iniciación erróneos resulta letal para las bacterias susceptibles.
La nueva molécula antibiótica era estreptomcina[8]. Su estructura química se desentrañó en 1947[9]. Aun cuando se relacionaba químicamente con la estreptotricina, no mostraba la toxicidad renal de esta última en animales de experimentación. Además, su espectro antibacteriano no se ceñía a la tuberculosis, siendo activa frente al bacilo de la peste (Yersinia pestis), brucelosis («fiebre de Malta») y varias formas de disentería. La estreptomicina tiene estructura de aminoglucósido. Su mecanismo de acción (extrapolable a todos los antibióticos con estructura de aminoglucósido es la siguiente: interferencia con la síntesis proteica bacteriana, más específicamente con proteínas de la unidad ribosómica [bacteriana] 30S[10] Ello trasunta en la traducción errónea del ARNM. Durante el proceso de traducción (ARNM ® proteína) se incorporan aminoácidos erróneos en la cadena proteica en crecimiento. Sin embargo, incluso la síntesis de proteínas incorrectas puede ser insuficiente para lograr una acción bactericida. También se ha teorizado que los antibióticos aminoglucósidos causan el desacoplamiento del ribosoma-ARNM re-acoplándose en presencia del antibiótico para formarse un complejo de iniciación anormal. La acumulación de estos complejos de iniciación erróneos resulta letal para las bacterias susceptibles.
Estudios con microscopía electrónica han evidenciado que los aminoglucósidos forman una suerte de ampollas en la membrana bacteriana. La presencia de otros antibióticos (Cloranfenicol, Eritromicina y tetraciclinas) bloquean la formación de estas ampollas por los aminoglucósidos y, con ello, su acción bactericida. De este hallazgo se infiere la trascendencia de este mecanismo de acción de los aminoglucósidos sobre la membrana de las bacterias susceptibles.
Bryan y van den Elzen[11] dedujeron el mecanismo por el que penetran estos antibióticos en las bacterias, estructurándolo en tres etapas: (1ª) asociación del antibiótico a la membrana por interacción electrostática; (2ª) engarce del antibiótico a quinonas de la membrana bacteriana. El complejo (antibiótico ↔ radicales tipo quinona) así formado difunde al interior del citosol bacteriano; y (3ª) unión de los aminoglucósidos a los ribosomas bacterianos. Este proceso es muy dependiente del metabolismo aeróbico[12]. Las quinonas no están presentes en las membranas de las bacterias anaerobias estrictas, tales como Clostridium spp. Ello explica que sean refractarias a los antibióticos aminoglucósidos.
Un trabajo clásico sobre la cinética de la Estreptomicina se publicó en el año 1946[13].
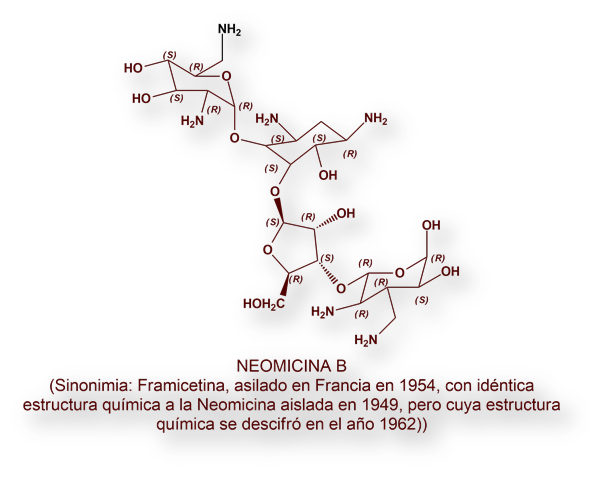 Seis años más tarde del descubrimiento de la estreptomicina (1943), el grupo de trabajo de Waksman aisló otro célebre antibiótico: la Neomicina (1949) a partir de Streptomyces fradiae[14]. Era un antibiótico estructuralmente complejo, del que solo uno de los componentes, la Neomicina-B, se introdujo en terapéutica. Su estructura se descifró en 1962[15], y no fue sino hasta 1987[16] que se consiguió sintetizar en el laboratorio. Dada la neurotoxicidad de la Neomicina, su uso se restringe a formulaciones galénicas de uso tópico para infecciones tópicas, otológicas u oftalmológicas.
Seis años más tarde del descubrimiento de la estreptomicina (1943), el grupo de trabajo de Waksman aisló otro célebre antibiótico: la Neomicina (1949) a partir de Streptomyces fradiae[14]. Era un antibiótico estructuralmente complejo, del que solo uno de los componentes, la Neomicina-B, se introdujo en terapéutica. Su estructura se descifró en 1962[15], y no fue sino hasta 1987[16] que se consiguió sintetizar en el laboratorio. Dada la neurotoxicidad de la Neomicina, su uso se restringe a formulaciones galénicas de uso tópico para infecciones tópicas, otológicas u oftalmológicas.
Tras un extenso estudio clínico, financiado por la industria farmacéutica, se inició la producción a gran escala del antibiótico[17].
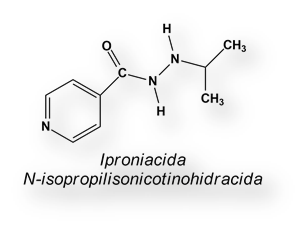
Durante muchos años, la Estreptomicina fue el antibiótico de elección frente a la tuberculosis. Las dosis requeridas eran elevadas, dañando el nervio aural. La asociación con el primer tuberculostático oral, la Iproniacida, a comienzos de la década de 1950 hizo posible la administración de dosis menores de Estreptomicina, reduciéndose la ototoxicidad[18] asociada a dosis elevadas.
El efecto adverso más importante de la Estreptomicina es la alteración vestibular con vértigo que, en algunos casos, puede degenerar en sordera irreversible. El riesgo de afectación vestibular está muy relacionado con la dosis administrada y, en última instancia, con concentraciones séricas elevadas durante breves períodos de tiempo. El riesgo [ototoxicidad] aumenta a partir de los 40 años, aun cuando los parámetros de función renal sean normales. Las personas más jóvenes disponen de mecanismos para compensar el daño vestibular causado por la Estreptomicina. Además, hay una susceptibilidad individual a la ototoxicidad de la Estreptomicina. Se han notificado cuadros de ototoxicidad en niños nacidos de madres tratadas con Estreptomicina durante sus embarazos.
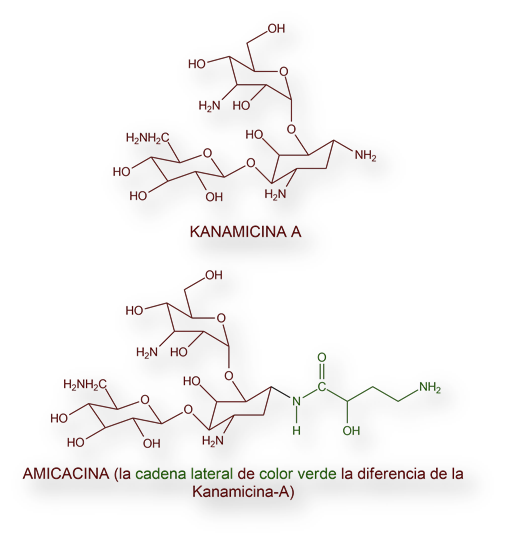
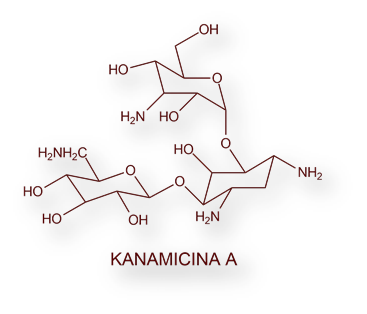 En el año 1957 Hamao Umezawa, a la sazón en el Instituto de Química Microbiana de Tokio aisló la Kanamicina, un antibiótico de notable complejidad estructural. De manera similar a lo sucedido con la Neomicina, se identificó la fracción más activa: Kanamicina-A (A, de activa [farmacológicamente]). La estructura química se desentrañó en 1958[19]; y la síntesis completa en laboratorio una década más tarde, en 1968[20]. Su toxicidad condicionó su uso generalizado, restringiéndose a las infecciones estafilocócicas resistentes a la penicilina, y aquellas derivadas de infecciones por bacterias Gram negativas.
En el año 1957 Hamao Umezawa, a la sazón en el Instituto de Química Microbiana de Tokio aisló la Kanamicina, un antibiótico de notable complejidad estructural. De manera similar a lo sucedido con la Neomicina, se identificó la fracción más activa: Kanamicina-A (A, de activa [farmacológicamente]). La estructura química se desentrañó en 1958[19]; y la síntesis completa en laboratorio una década más tarde, en 1968[20]. Su toxicidad condicionó su uso generalizado, restringiéndose a las infecciones estafilocócicas resistentes a la penicilina, y aquellas derivadas de infecciones por bacterias Gram negativas.
Un derivado de la Kanamicina-A se sintetizó en el Bristol-Banyu Research Institute[21], en Tokio. Su principal ventaja era su resistencia a las enzimas que inactivaban la Kanamicina-A mediante reacciones de fosforilación, adenilación de grupos hidroxilo, y acetilación de grupos amino.
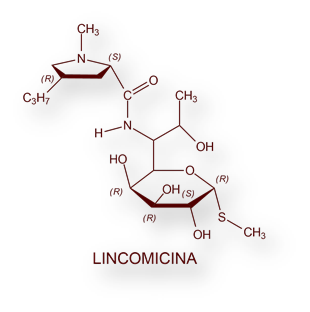
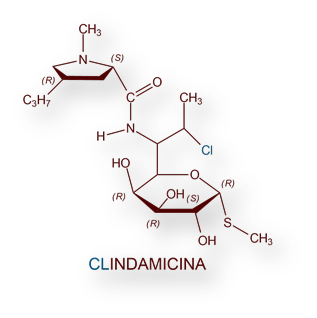 Otro antibiótico, Lincomicina, se aisló de Streptomyces lincolnensis en 1962. La denominación, tanto de la especie de Streptomyces [lincolnesis], como del propio antibiótico deriva de que el actinomiceto [del género Streptomyces] se obtuvo de una muestra del suelo en Lincoln, Nebraska, Estados Unidos. Su estructura química se dedujo en 1964, y su síntesis química en laboratorio en el año 1970. Su toxicidad y escasa biodisponibilidad lo descartaron para uso terapéutico. Sin embargo, un derivado, Clindamicina (7-cloro-lincomicina), sintetizado por Robert Birkenmeyer y Fred Kagan en 1966[22] se mostró activo frente a muchas bacterias Gram[23] positivas (incluyendo estafilococos), Gram negativas y anaerobios (v gr Bacteroides fragilis). La Clindamicina difunde muy bien en tejidos, por lo que se considera una excelente opción terapéutica en infecciones estafilocócicas óseas y articulares. Su principal riesgo es la colitis seudomembranosa.
Otro antibiótico, Lincomicina, se aisló de Streptomyces lincolnensis en 1962. La denominación, tanto de la especie de Streptomyces [lincolnesis], como del propio antibiótico deriva de que el actinomiceto [del género Streptomyces] se obtuvo de una muestra del suelo en Lincoln, Nebraska, Estados Unidos. Su estructura química se dedujo en 1964, y su síntesis química en laboratorio en el año 1970. Su toxicidad y escasa biodisponibilidad lo descartaron para uso terapéutico. Sin embargo, un derivado, Clindamicina (7-cloro-lincomicina), sintetizado por Robert Birkenmeyer y Fred Kagan en 1966[22] se mostró activo frente a muchas bacterias Gram[23] positivas (incluyendo estafilococos), Gram negativas y anaerobios (v gr Bacteroides fragilis). La Clindamicina difunde muy bien en tejidos, por lo que se considera una excelente opción terapéutica en infecciones estafilocócicas óseas y articulares. Su principal riesgo es la colitis seudomembranosa.
La diarrea es un efecto adverso muy conocido de la Lincomicina (y Clindamicina). En ocasiones, la diarrea persiste durante 1 o 2 semanas, derivando en colitis ulcerosa. La colitis seudomembranosa puede debutar a cabo de entre 2 y 25 días de iniciar el tratamiento antibiótico. Aun cuando se vincula con el tratamiento con Lincomicina y Clindamicina, puede aparecer tras cualquier tratamiento antibiótico (excepto con Vancomicina).
A pesar de la creencia que se trata de un efecto adverso asociado a tratamientos antibióticos, se trata de una enfermedad que ya existía en la era pre-antibiótica[24].
 La Gentamicina se aisló de dos microorganismos: Micromonospora purpurea y Micromonospora echinospora, por un grupo de investigación de Schering Corporation[25], en Bloomfield, New Jersey, Estados Unidos. Era el año 1963, determinándose su estructura química cuatro años después (1967). Durante algunos años fue el antibiótico electivo para las infecciones por Pseudomonas spp. Otros aminoglucósidos le siguieron: Amikacina, Netilmicina y Tobramicina.
La Gentamicina se aisló de dos microorganismos: Micromonospora purpurea y Micromonospora echinospora, por un grupo de investigación de Schering Corporation[25], en Bloomfield, New Jersey, Estados Unidos. Era el año 1963, determinándose su estructura química cuatro años después (1967). Durante algunos años fue el antibiótico electivo para las infecciones por Pseudomonas spp. Otros aminoglucósidos le siguieron: Amikacina, Netilmicina y Tobramicina.
La Netilmicina[26] es el análogo desmetilado de la Gentamicina. Su escasa toxicidad renal lo convierte en una excelente opción terapéutica en pacientes ancianos.
Desde su descubrimiento, la Gentamicina se reservó para infecciones por gérmenes aerobios Gram negativos, sobre todo en el ámbito hospitalario. A partir de mediados de la década de 1970 ha perdido preeminencia por la aparición de bacterias resistentes y por la incorporación al vademécum antibiótico de las cefalosporinas de 3ª generación y algunas fluoroquinolonas.
La Netilmicina es un antibiótico semisintético derivado de la sisomicina. Su espectro antibacteriano (in vitro) es muy similar al de la Gentamicina. Sin embargo conserva su actividad frente a cepas con resistencia plasmídica a la Gentamicina.
La Tobramicina, conocido previamente como nebramicina-factor-6, dado que era el compuesto 6º de un antibiótico complejo denominado nebramicina, aislado de Streptomyces tenebrarius[27]. Es menos nefrotóxico que la Gentamicina, y tiene una mayor actividad intrínseca frente a Pseudomonas aeruginosa.
La Amikacina es el derivado S-4-aminobutirilo de la Kanamicina (véanse estructuras químicas). Su espectro antibacteriano es más amplio que los de Kanamicina, Gentamicina y Tobramicina. La cadena lateral (S-4-aminobutirilo-amino – resaltada en color verde en la fórmula) mantiene la sensibilidad frente a bacilos Gram negativos que se han tornado resistentes por transferencia plasmídica.
Zaragoza, a 18 de mayo de 2020
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Farmacia Las Fuentes
Florentino Ballesteros, 11-13
50002 Zaragoza
[1] Humus: término genérico que designa el conjunto de materia orgánica en descomposición. Su color negro se debe a la elevada presencia de carbono.
[2] Greig-Smith R. Contribution to our knowledge of soil: the action of certain microorganisms upon the numbers of bacteria in the soil. Proc. Linn. Soc. NSW, 1917: 42: 162-6.
[3] Lieske R. Leipizg: Borntraeger, 1921; pp: 138-43.
[4] Gratia A., Dath S. Propiétés bacteriolytiques de certains moisissures. C. R. Soc. Biol. 1925; 91: 1442-3 // 1925; 92: 461-2.
[5] Waksman S.A., Woodruff H.B. Bacteriostatic and bactericidal substances produced by soil Actinomyces. Proc. Soc. Exp. Biol. Med., 1940; 45: 609-14.
[6] Waksman S.A., Geiger W.B. The nature of antibiotic substances produced by Aspergyllus fumigatus. J. Bacteriol., 1944; 47: 391-7.
[7] La clasificación del género Streptomyces se inició en 1964 con el proyecto ISP (International Streptomyces Project). Se consiguió reorganizar la taxonomía del género reduciendo el número de especies, de 463 a 142 (Manual de Sistemática Bacteriológica de Bergey, 1972).
[8] Schatz A., Bugie S.A. Waksman S.A. Streptomycin, a substance exhibiting antibiotic activity against Gram positive and Gram negative bacteria. Proc. Soc. Exp. Biol. Med., 1944; 55: 66-9.
[9] Waksman S.A. Streptomycin, Nature and Practical Applications. Baltimore, Maryland. Williams & Wilkins; 1949.
[10] S: unidad de sedimentación establecida por el sueco Theodor Svedberg, Premio Nobel de Química en 1926 por sus investigaciones sobre las dispersiones (disoluciones de coloides)
[11] Bryan L.E., Kwan S. Roles of ribosomal binding, membrane potential, and electron transport in bacterial uptake of streptomycin and gentamicin. Antimicrob. Ag. Chemother., 1983; 23: 835.
[12] Saunders J.R., Saunders V.A. Energetic and antibiotic uptake. Nature 1977; 270: 475.
[13] Adcock J.D., Hettig R.A. Absortion, distribution and excretion of streptomycin. Arch. Intern. Med. 1946; 77: 179.
[14] Waksman S.A., Lechevalier H.A. Neomycin, a new antibiotic active against streptomycin-resistant bacteria, including tuberculosis organisms. Science, 1949; 109: 305-7.
[15] Rinehart K.L., et al. Chemistry of the neomycins. Neomycins B and C. J. Am. Chem. Soc. 1962; 84: 3218-20.
[16] Usui T., Umezawa H. Total synthesis of neomycin B. J Antibiot., 1987; 40: 1464-7.
[17] Brink N.G., Folkers K. in Streptomycin, ed. S.A. Waksman. Baltimore, Maryland: Williams & Wilkins; 1949.
[18] Cawthorne T., Ranger D. Toxic effect of streptomycin upon balance and hearing. BMJ 1957; 1: 1444.
[19] Cron M.J., et al. The structure of kanosamine. J. Am. Chem. Soc., 1958; 80: 4741-2.
[20] Umezawa S., et al. The total synthesis of kanamycin A. J. Antibiot., 1968; 21: 367-8.
[21] Kawaguchi H., et al. BB-K 8, a new semisynthetic aminoglycoside antibiotic. J. Antibiot., 1972; 25: 695-708.
[22] Magerlein B.J., Birkenmeyer R.D., Kagan, F. Chemical modification of lincomycin. Antimicrob. Agents Chemother 1966; 727-36.
[23] Gram: tinción diseñada por el bacteriólogo danés Christian Gram. Las bacterias se clasifican en dos grupos según fijen, en mayor o menor medida el colorante. El fundamento es la presencia de una envoltura de peptidoglucano (pared celular) rodeando la membrana en las bacterias Gram positivas; y la ausencia (o mínima presencia) de esta estructura de peptidoglucano en las bacterias Gram negativas.
[24] Keusch G.T., Present D.H. Summary of Workshop on clindamycin colitis. J. Infect. Dis. 1976; 133: 578.
[25] Wenstein M.J:, et al. Gentamicin, a new antibiotic complex from Micromonospora. J. Med. Chem., 1963; 6: 463-4.
[26] Miller G.H., et al. Biological activity of netilmicine, a broad-spectrum semisynthetic aminoglycoside antibiotic. Antimicrob. Agents Chemother., 1976; 10: 827-36.
[27] Preston D.A., Wick W.E. Pre-clinical assessment of the antibacterial activity of Nebramycin factor 6. Antimicrob. Agents Chemother. 1970; pag. 322.