Leon Tshilolo, hematólogo pediátrico del hospital Monkole, Kinshasa, República Democrática del Congo, responsable táctico del estudio.
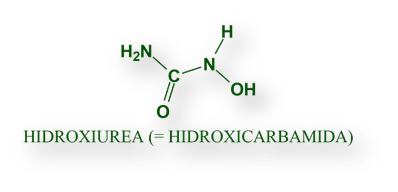 La Hidroxiurea (sinonimia: Hidroxicarbamida) es un fármaco barato y cómodo de tomar. Un estudio reciente ha demostrado su eficacia en la anemia de células falciformes, también denominada drepanocitosis, una genopatía que, en condiciones de homocigosis causa una anemia grave, pero en heterocigosis protege frente a la infección palúdica. [En el texto que sigue usamos anemia
La Hidroxiurea (sinonimia: Hidroxicarbamida) es un fármaco barato y cómodo de tomar. Un estudio reciente ha demostrado su eficacia en la anemia de células falciformes, también denominada drepanocitosis, una genopatía que, en condiciones de homocigosis causa una anemia grave, pero en heterocigosis protege frente a la infección palúdica. [En el texto que sigue usamos anemia
falciforme o drepanocitosis, de forma indistinta].
La Hidroxiurea, relativamente útil en para los pacientes con anemia falciforme en los países desarrollados, ha demostrado una inusitada eficacia en África
En el año 1945, Linus Carl Pauling descubrió la naturaleza hereditaria de la drepanocitosis. No obstante, la entidad nosológica ya se había descrito en los albores de siglo XX. [Linus Carl Pauling fue de los pocos científicos que fue reconocido dos veces con el Premio Nobel: en 1954 con el Premio Nobel de Química por sus trabajos sobre el enlace químico; y en 1962 con el Premio Nobel de la Paz, aunque le fue entregado al año siguiente, 1963].
 La drepanocitosis se debe a una mutación autosómica recesiva del codón 6 del gen β de la hemoglobina, en la que el nucleótido Timina es sustituido por Adenina. Esta mutación se traduce en la sustitución del aminoácido ácido glutámico por el aminoácido valina en la posición 86 de la secuencia de la subunidad β de la estructura tetrámero de la hemoglobina (α2β2). Esta sustitución modifica la carga eléctrica neta de la hemoglobina y, consecuentemente, su movilidad electroforética.
La drepanocitosis se debe a una mutación autosómica recesiva del codón 6 del gen β de la hemoglobina, en la que el nucleótido Timina es sustituido por Adenina. Esta mutación se traduce en la sustitución del aminoácido ácido glutámico por el aminoácido valina en la posición 86 de la secuencia de la subunidad β de la estructura tetrámero de la hemoglobina (α2β2). Esta sustitución modifica la carga eléctrica neta de la hemoglobina y, consecuentemente, su movilidad electroforética.
La patología de la anemia falciforme (drepanocitosis) se manifiesta en personas homocigóticas (portadoras de los dos alelos mutados).
La anemia es moderada en personas heterocigóticas (un alelo mutado, el otro normal). La condición de heterocigóticos protege frente a la infección por malaria. Así pues, la drepanocitosis es un mecanismo evolutivo que protege a los portadores heterocigóticos frente a la infección por malaria, pero al precio de «sacrificar» la salud de los homocigóticos (portadores de los dos alelos mutados).
Los hematíes (eritrocitos) de las personas portadoras de la mutación son más rígidos y adoptan la forma de hoz (sickle, en inglés) o de «luna en cuarto creciente», en la que las formas hemáticas del parásito de la malaria no puede acomodarse, bloqueándose así la fase hemática del plasmodio. [Véase ciclo biológico del plasmodio en el link: http://www.info-farmacia.com/microbiologia/ciclo-vital-del-parasito-de-la-malaria
La mortandad en personas homocigóticas para la condición clínica de drepanocitosis es elevada. El tratamiento se ha de llevar a cabo con periódicas trasfusiones de sangre completa. No obstante, estas personas sufren hemosiderosis, condición clínica que requiere tratamiento con quelantes del hierro, bien por vía intravenosa (Deferoxamina, forma apocopada de Desferrioxamina) u oral (Deferasirox).
Bibliografía recomendada:
- Halsey C. Roberts IAG. The role of Hydroxyurea in sickle cell disease. Br J Haematol 2003; 120: 177-86.
- Charache S., et al. Effects of Hydroxyurea on the frequency of painful crisis in sickle cell anaemia. N Engl J Med 1995; 332: 1317-22.
La mutación de la anemia falciforme surgió en África hace aproximadamente 7.000 años.
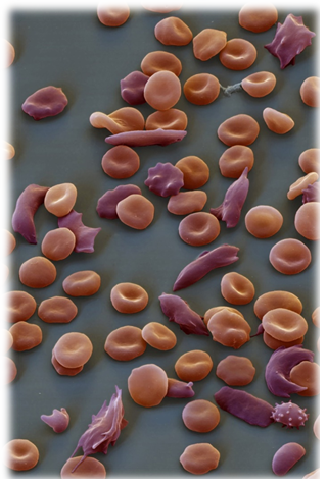
 La hemoglobina normal se designa con la letra A, mientras la hemoglobina de la anemia falciforme se designa con la letra S (de sickle, hoz). La formación de agregados de hemoglobina no oxigenada deforma el eritrocito (hematíes) que adopta forma de media luna o de hoz. Estos hematíes son más rígidos, taponan los pequeños vasos de resistencia y son más frágiles, y su vida media es más breve en relación con la de los hematíes normales, que es de aproximadamente 120 días. El resultado es una anemia crónica.
La hemoglobina normal se designa con la letra A, mientras la hemoglobina de la anemia falciforme se designa con la letra S (de sickle, hoz). La formación de agregados de hemoglobina no oxigenada deforma el eritrocito (hematíes) que adopta forma de media luna o de hoz. Estos hematíes son más rígidos, taponan los pequeños vasos de resistencia y son más frágiles, y su vida media es más breve en relación con la de los hematíes normales, que es de aproximadamente 120 días. El resultado es una anemia crónica.
Mientras la anemia de células falciformes es consecuencia de una mutación en la que se sustituye un aminoácido en una cadena β de la proteína tetrámero hemoglobina (α2β2), otras hemoglobinopatías como la talasemia β es el resultado de otra mutación que tiene por resultado una insuficiente síntesis de la subunidad β de la hemoglobina.
Cada año nacen con anemia falciforme alrededor de 300.000 niños, el 75% de ellos en África.
Esta genopatía es también prevalente en las zonas de América y las islas bañadas por el mar Caribe, muchos de cuyos habitantes descienden de africanos que arribaron como esclavos. Con mucha menor frecuencia, la anemia falciforme también se observa en los países europeos bañados por el Mediterráneo, Oriente Medio y el subcontinente indio.
La distribución geográfica de la anemia falciforme concuerda con regiones en las que la malaria (paludismo) es endémica, o lo fue hasta hace unas décadas. Por ejemplo, la mutación falciforme es común entre los niños que viven en la costa de la isla de Cerdeña, mientras es prácticamente inexistente entre los niños que habitan en las regiones montañosas, un patrón de distribución coincidente con el de la malaria, cuando la enfermedad era endémica en la isla.
Como se ha escrito antes, las personas heterocigóticas para la mutación falciforme están parcialmente protegidas contra la malaria. Este hecho explica la coincidente distribución geográfica de la parasitosis y la genopatía.
Los niños que heredan de sus padres las dos copias (alelos) mutados, homocigóticos, padecen la sintomatología asociada a una anemia grave (dificultad respiratoria por insuficiente transporte de oxígeno, mayor riesgo de infecciones y trombosis o embolias por taponamiento de pequeños vasos con los hematíes falciformes). De modo usual, la tercera parte de los pacientes desarrollan hipertensión pulmonar que deriva en grave insuficiencia cardíaca. Es común la ictericia manifestada por coloración amarillenta de la conjuntiva y la piel. El dolor puede ser muy intenso, debido a la anoxia tisular. En ocasiones el dolor es tan lacerante que requiere tratamiento opiáceo. La mejor opción terapéutica en la anemia falciforme homocigótica es el trasplante de médula ósea, si bien es difícilmente realizable en el contexto africano por razones de costo.
En ausencia de tratamiento, muchos niños fallecen por ictus o daño en órganos vitales.
La Hidroxiurea (Hidroxicarbamida) se ha usado durante años en países desarrollados. Sin embargo, existía el temor de usarlo en niños africanos por el riesgo teórico de que aumentase la susceptibilidad de contagio de malaria.
El estudio publicado realizó un seguimiento de 600 niños de Angola, Uganda, Kenia y la República Democrática del Congo. Todos ellos recibieron Hidroxiurea durante más de dos años.
La primera observación era previsible: la toma diaria del fármaco reducía el número de trasfusiones y la intensidad y frecuencia de las crisis dolorosas.
La segunda observación, menos esperada, fue que estos niños tenían menor probabilidad de contagio de malaria, así como de otras infecciones.
Este estudio, dirigido por Rusell E. Ware, director a la sazón del hospital infantil de Cincinnati, Estados Unidos, se presentó en el simposio de la American Society of Haematology, publicándose en la revista The New England Journal of Medicine.
La Hidroxiurea está incluida en la lista de medicamentos esenciales de Organización Mundial de la Salud. Existen versiones genéricas muy baratas, y se puede almacenar a temperatura ambiente, una gran ventaja en África.
Con ser muy interesante, el estudio tiene algunas limitaciones: solo se evaluó su eficacia en niños de 2 a 10 años de edad; no hubo brazos de estudio que permitiesen establecer la dosis óptima; tampoco se realizaron estimaciones acerca de cuántas pruebas de laboratorio eran precisas para valorar la eficacia y toxicidad del tratamiento.
Por razones éticas no existió grupo placebo, ya que la eficacia del tratamiento estaba fuera de toda duda razonable.
Al objeto de compensar la ausencia de un grupo placebo, los investigadores supervisaron clínicamente a los niños durante dos meses antes de instaurar tratamiento con Hidroxiurea. Se tuvieron en cuenta la frecuencia e intensidad de las crisis dolorosas, la necesidad de trasfusiones y la incidencia de brotes de malaria y otras infecciones.
Originalmente la Hidroxiurea se desarrolló para el tratamiento de cánceres hematológicos. A las dosis usadas como antineoplásico, los efectos adversos más importantes son leucopenia y trombocitopenia.
A las dosis empleadas en la anemia de células falciformes, las leucopenias y trombocitopenias fueron muy infrecuentes. De hecho solo fue necesaria la reducción de dosis por toxicidad hematológica en el 5% de todos los niños.
La Food and Drug Administration (FDA) norteamericana autorizó la prescripción de Hidroxiurea en pacientes adultos con anemia de células falciformes en el año 1998. Sin embargo, los estudios acerca de la seguridad en niños concluyeron en 2016, abriendo el camino para su ensayo en niños africanos. El ensayo clínico que sirvió de aval para la aprobación de la formulación pediátrica de Hidroxiurea fue el designado con el acrónimo ESCORT (European Sickle Cell Disease Cohort study), en el que participaron 405 pacientes de entre 2 y 18 años, de los que 141 eran naïve para la Hidroxiurea.
Finalmente la Hidroxiurea, fabricada por Addmedica, fue autorizada por la Food and Drug Administration, para el tratamiento pediátrico de niños con anemia falciforme el 21 de diciembre de 2017. El nombre registrado de la formulación de Hidroxiurea pediátrica es Silkos®.
Durante muchos años, los estadounidenses de raza negra con anemia de células falciformes fueron reacios a participar en ensayos clínicos. Amargas experiencias, como el infame estudio Tuskegee crearon, no sin razón, enormes suspicacias.
Hidroxiurea reduce la espermatogénesis, disminuye el crecimiento capilar en mujeres, y tizna las uñas de gris oscuro. Por prudencia no se administra a embarazadas.
La malaria continúa siendo un enorme problema de salud global. Cualquier estrategia destinada a disminuir su incidencia y prevalencia, sobre todo entre los niños, las principales víctimas, ha de ser valorado con el máximo interés.
Zaragoza, a 14 de diciembre de 2018
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Farmacia Las Fuentes
Florentino Ballesteros, 11-13
50002 Zaragoza

