La Food and Drug Administration estadounidense (US-FDA) ha autorizado con criterios de prioridad un nuevo genérico del Valsartán con el fin de suplir los desabastecimientos producidos por la retirada de diversas marcas genéricas del fármaco debido a la presencia de sustancias potencialmente carcinogénicas.
El nuevo genérico de Valsartán es fabricado por Alkem Laboratories Ltd., con sede en Mumbai, India.
Las retiradas de varias marcas genéricas de Valsartán comenzaron en julio de 2018, desencadenándose una escasez crónica de uno de los medicamentos antihipertensivos más prescritos.
La retirada de numerosos lotes de varias marcas genéricas de Valsartán se ha debido a la presencia de una sustancia con potencial cancerígeno, la N-nitrosodimetilamina, abreviada por su acrónimo NDMA. La Agencia Europea del Medicamento se anticipó en la retirada.
 N-nitrosodimetilamina es un subproducto producido durante la síntesis del principio activo. Los procedimientos para eliminar cualquier resto de esta sustancia no se realizaron del modo exigido durante la fabricación de los lotes afectados. Las buenas prácticas de fabricación (GMP, Good Manufacturing Proceedings) no se han cumplido en estos casos.
N-nitrosodimetilamina es un subproducto producido durante la síntesis del principio activo. Los procedimientos para eliminar cualquier resto de esta sustancia no se realizaron del modo exigido durante la fabricación de los lotes afectados. Las buenas prácticas de fabricación (GMP, Good Manufacturing Proceedings) no se han cumplido en estos casos.
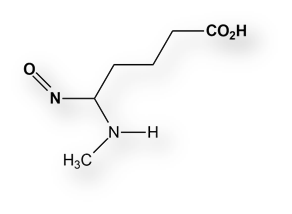
La N-nitrosodimetilamina (de hecho, todas las nitrosaminas) pueden dar lugar a tumores hepáticos en animales de laboratorio; y cabe inferir que también en humanos.
Diversas marcas genéricas de Valsartán fueron retiradas en diversos países, situación que propició que algunos fabricantes de marcas no afectadas por la retirada de los lotes incrementaran sus precios en aquellos mercados farmacéuticos de precio no regulado, como el estadounidense.
El principio activo, Valsartán, contaminado procedía de un fabricante chino, Zhejiang Huahai Pharmaceutical Company. Fue distribuido en Estados Unidos por tres empresas farmacéuticas: Major Pharmaceuticals, Teva Pharmaceuticals y Solco Healthcare, esta última propiedad de la empresa china fabricante del principio activo defectuoso.
La investigación detectó las mismas impurezas en otros dos principios activos antihipertensivos de la misma clase farmacológica que el Valsartán, esto es los «antagonistas del receptor-II de la angiotensina», a los que se suele denominar de modo abreviado «ARA-II», que prescriben para el de la hipertensión arterial y la insuficiencia cardíaca. Se trata de los principios activos: Irbesartán y Losartán.
 En estos principios activos se hallaron restos de otras dos nitrosaminas: nitrosodietilamina (NDEA), y ácido N-nitroso-N-metil-4-aminobutírico (NMBA). En el caso de Irbesartán y Losartán estaban involucrados otros fabricantes, también de la República Popular China. Una información más exhaustiva está publicada en la página web de la Food and Drug Administration.
En estos principios activos se hallaron restos de otras dos nitrosaminas: nitrosodietilamina (NDEA), y ácido N-nitroso-N-metil-4-aminobutírico (NMBA). En el caso de Irbesartán y Losartán estaban involucrados otros fabricantes, también de la República Popular China. Una información más exhaustiva está publicada en la página web de la Food and Drug Administration.
Las nitrosaminas son peligrosas para la salud porque son cancerígenas incluso en cantidades mínimas.
 Es importante advertir que la interrupción drástica de los tratamientos farmacológicos puede ser más peligrosa para la salud que la toma de medicamentos conteniendo trazas de estas sustancias nocivas. Los pacientes deben sustituir la toma por lotes no afectados del mismo principio activo, por otra marca genérica del principio activo, o por otro fármaco de la misma clase farmacológica. Todo ello bajo supervisión clínica.
Es importante advertir que la interrupción drástica de los tratamientos farmacológicos puede ser más peligrosa para la salud que la toma de medicamentos conteniendo trazas de estas sustancias nocivas. Los pacientes deben sustituir la toma por lotes no afectados del mismo principio activo, por otra marca genérica del principio activo, o por otro fármaco de la misma clase farmacológica. Todo ello bajo supervisión clínica.
Con todo, no hay que exagerar los peligros. Existen muchos productos ambientales con un riesgo cancerígeno mucho más elevado que el derivado de la presencia de estas sustancias. No obstante, su presencia no es aceptable en un mercado farmacéutico que aspire a la excelencia.
Zaragoza, a 14 de marzo de 2019
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Farmacia Las Fuentes
Florentino Ballesteros, 11-13
50002 Zaragoza

