El lunes, 16 de marzo de 2020, el National Institute of Allergy and Infectious Diseases estadounidense ha informado del comienzo del primer ensayo de una potencial vacuna contra la infección por coronavirus SARS-Covid-19. El objetivo de estas pruebas preliminares es conocer si la vacuna es segura y, por consiguiente, se considera adecuado continuar su investigación. Aun cuando se trata de una prioridad mundial, es absolutamente necesario consolidar unos mínimos protocolos de seguridad.
La rapidez del desarrollo de una vacuna contra una nueva enfermedad no tiene precedentes.
El desarrollo de la vacuna contra la epidemia del SARS del año 2003 tardó 20meses, no llegando a usarse porque la infección desapareció de modo tan súbito como había surgido; la vacuna contra la gripe A/Indonesia H5N1 se preparó en 11 meses; la vacuna contra la gripe A/California H1N1 se obtuvo en 4 meses; y la vacuna contra el virus Zika, en tan solo 3,5 meses. Bien es verdad que ahora la humanidad se enfrenta a una pandemia que podría enfermar a millones de personas en todo el mundo, incluso con las drásticas restricciones instauradas.
Aun cuando el programa de desarrollo de la vacuna para prevenir el contagio con el coronavirus Covid-19 no sufra contratiempos, se considera improbable su comercialización antes de varios meses.
Moderna Inc., ha iniciado las pruebas con esta vacuna, desarrollada por científicos del NIAID (acrónimo de National Institute of Allergy and Infectious Diseases). La Coalition for Epidemic Preparedness Innovations (CEPI) financia la fabricación del número de dosis requeridas. Las pruebas iniciales se realizan en 45 voluntarios sanos de un rango de edad entre 18 y 55 años a los que se les inyectan dosis variables de la vacuna experimental en distintos momentos a lo largo de seis meses, según el grupo (cohorte) en el estén incluidos. El estudio se lleva a cabo en el Kaiser Permanente Washington Health Research Institute, estando dirigido por Lisa A. Jackson, investigadora senior. Para el ensayo se eligió la ciudad de Seattle antes de que se notificaran casos de coronavirus en el Estado noroccidental de Washington. Sin embargo, desde que se tomó la decisión, la infección se ha extendido afectando en la actualidad (16 de marzo de 2020) a más de 670 personas.
El laboratorio (Moderna Inc.) utiliza ARN mensajero para elaborar vacunas. Recordemos que el Covid-19 es un virus ARN. La empresa farmacéutica Moderna Inc., ha patentado una tecnología que le permite formular vacunas contra «virus-ARN» (virus que contienen ácido ribonucleico como material genético). En la actualidad el laboratorio tiene otras nueve vacunas experimentales en diferentes estadios de investigación, incluidas varias para virus que causan enfermedades respiratorias. Hasta la fecha (marzo de 2020), no se ha comercializado ninguna.
Una de las ventajas de esta tecnología, patentada por Moderna Inc. permite el desarrollo de vacunas en un tiempo relativamente breve (varios meses). Sin embargo, la rapidez de su preparación no debe ir en detrimento de la seguridad.
Las nueve vacunas que Moderna Inc. tiene en fase de investigación se dirigen contra virus potencialmente pandémicos, como el actual Covid-19.
Otras empresas farmacéuticas están tratando de elaborar posibles vacunas contra la actual pandemia de SARS-Covid-19. Sin embargo, la vacuna contra Covid-19 de Moderna Inc. es la primera con la que se ha iniciado un ensayo clínico (fase 1) en humanos. Se ha informado de otra potencial vacuna desarrollada en laboratorios de la República Popular China de la que no dispongo información más allá de reseñas periodísticas. [Los estudios fases 1, 2 y 3 son preclínicos, mientras el ensayo clínico fase 4 se realiza tras la comercialización al objeto de detectar efectos adversos muy infrecuentes debido a su baja prevalencia].
Los participantes en este ensayo clínico son voluntarios sanos, de un rango de edad comprendido entre 18 y 55 años. Todos recibirán dos dosis por vía intramuscular de la vacuna experimental espaciadas 28 días.
La vacuna ha recibido la designación preclínica ARNM-1273. Como se ha escrito antes ha sido desarrollada por el National Institute of Allergy and Infectious Diseases, en colaboración con científicos de la empresa de biotecnología Moderna Inc, Los participantes han sido divididos en tres grupos (cohortes en el lenguaje estadístico). Las personas de cada cohorte serán tratadas con dosis diferentes (desde 25mcg hasta 250mcg), siguiendo un escalado de dosificación para limitar los posibles riesgos. El objetivo final es hallar la dosis que ofrezca mayor protección con menor riesgo. El objetivo de este estudio clínico fase 1 es evaluar la seguridad de la vacuna, comprobar si estimula la fabricación de anticuerpos, y, en última instancia, prevenir el contagio.
El ensayo se está llevando bajo estrictas medidas de control: los participantes son monitorizados al objeto de reducir hasta donde sea posible los riesgos para su salud.
Además, todos serán monitorizados clínicamente durante un año, tras la finalización del estudio. Además, los resultados del ensayo se harán públicos en pocas semanas. El laboratorio (Moderna Inc) solicitará a la Food and Drug Administration (FDA) estadounidense autorización para iniciar la siguiente fase de estudio (ensayo clínico fase 2), aun antes de analizar de modo pormenorizado la información recopilada en esta primera etapa (ensayo clínico fase 1).
Para esta tarea, la empresa farmacéutica Moderna Inc, con sede en Cambridge, Massachusetts, Estados Unidos ha dispuesto de la planta de producción en Norwood.
Las investigaciones para lograr una vacuna contra el coronavirus SARS-Covid-19 se iniciaron en enero cuando Shangai Public Health Clinical Center en colaboración con School of Public Health de la misma ciudad descifraron el genoma completo del virus, entregando la información desinteresadamente a la comunidad científica internacional (de hecho, la secuencia genómica del virus se puede consultar en internet). [En algunas publicaciones científicas se refieren como SARS-Covid-2, para diferenciarlo del causante del SARS del año 2003, que sería el SARS-Covid-1].
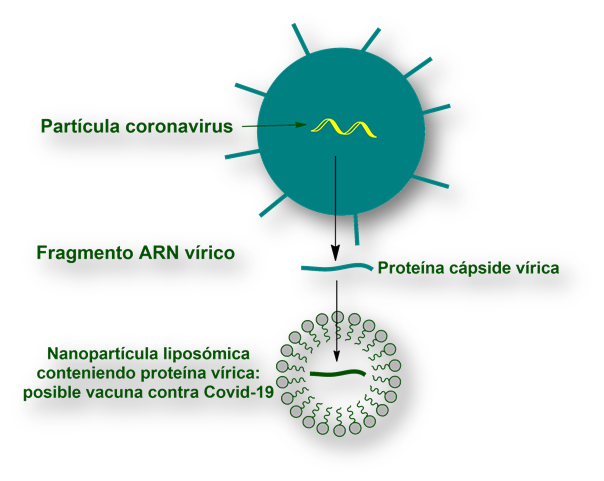 Investigadores del laboratorio [Moderna Inc.], con la colaboración del National Institute of Allergy and Infectious Diseases identificaron el gen del ARN vírico que codifica la proteína responsable de que el virus infecte las células. Este tipo de proteínas, unidas a azúcares (glucoproteínas) se visualizan bajo el microscopio electrónico, dando a la partícula vírica su apariencia de corona, de donde toma el nombre de coronavirus (véase imagen al comienzo del artículo).
Investigadores del laboratorio [Moderna Inc.], con la colaboración del National Institute of Allergy and Infectious Diseases identificaron el gen del ARN vírico que codifica la proteína responsable de que el virus infecte las células. Este tipo de proteínas, unidas a azúcares (glucoproteínas) se visualizan bajo el microscopio electrónico, dando a la partícula vírica su apariencia de corona, de donde toma el nombre de coronavirus (véase imagen al comienzo del artículo).
Las glucoproteínas (los «ganchos» del virus) constituyen la base para la vacuna. El laboratorio utiliza el fragmento de ARN vírico para sintetizar la proteína. A continuación, ésta se incluye en una nanopartícula liposómica. Esta nanopartícula conteniendo la proteína de la corona del virus constituye la verdadera vacuna. Se espera que las «células presentadoras de antígeno» expongan esta proteína vírica en su membrana para estimular al sistema inmunitario del organismo a producir anticuerpos.
El 24 de febrero (2020) Moderna Inc había fabricado un lote de vacunas lista para su ensayo. El 4 de marzo, la Food and Drug Administration (FDA) estadounidense autorizó el inicio del estudio.
Zaragoza, a 20 de marzo de 2020
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Farmacia Las Fuentes
Florentino Ballesteros, 11-13
50002 Zaragoza

