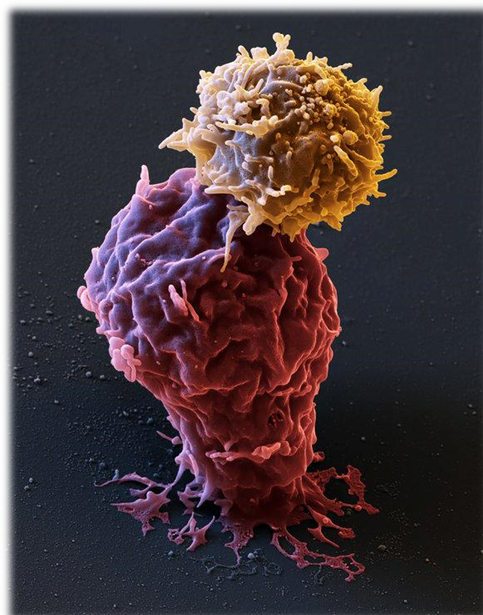
Imagen (procesada para otorgarle coloración) obtenida con microscopio electrónico de barrido del ataque de una célula-T CAR (célula T modificada genéticamente) contra una célula leucémica. [CAR es el acrónimo de Chimeric Antigen Receptor]
[La tecnología de microscopía electrónica de barrido fue desarrollada por el sueco Kai M. Siegbahn. Fue galardonado con el Premio Nobel de Física en el año 1981, junto con Nicolaas Bloemberg ex aequo Arthur Leonard Schawlow, éstos dos últimos por su descubrimiento de la espectrocopía láser].
Un inesperado fallecimiento reciente ha representado un varapalo en la ola de entusiasmo que representa la terapia celular (una forma de inmunoterapia anticancerosa), sobre todo cuando la Fundación Nobel ha reconocido con el Premio Nobel de Fisiología y Medicina 2018 la investigación básica en que se ha fundamentado el desarrollo de las primeras inmunoterapias.
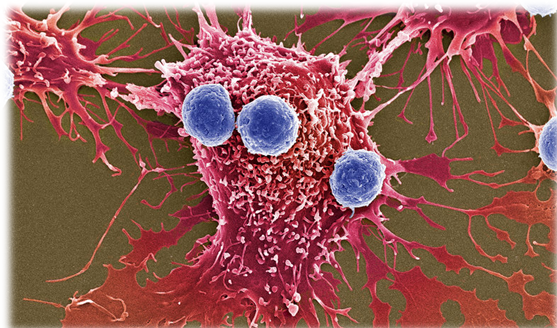 Conceptualmente, la terapia celular consiste en rediseñar un tipo de leucocitos (las células T, derivadas de los linfocitos T) habilitándolos para luchar contra las células neoplásicas. En cierta forma las células T actúan como verdaderos «fármacos» con capacidad de multiplicarse exponencialmente en el interior del organismo enfermo. Se han logrado espectaculares remisiones de cánceres en estadios avanzados. Un ejemplo fue el de Emily Whitehead en el año 2012, entonces una niña de 6 años afectada de un cáncer en fase terminal.
Conceptualmente, la terapia celular consiste en rediseñar un tipo de leucocitos (las células T, derivadas de los linfocitos T) habilitándolos para luchar contra las células neoplásicas. En cierta forma las células T actúan como verdaderos «fármacos» con capacidad de multiplicarse exponencialmente en el interior del organismo enfermo. Se han logrado espectaculares remisiones de cánceres en estadios avanzados. Un ejemplo fue el de Emily Whitehead en el año 2012, entonces una niña de 6 años afectada de un cáncer en fase terminal.
Este tipo de tratamientos conllevan riesgos importantes, incluso mortales. Los oncólogos y los pacientes son conscientes de hallarse ante una terapia de vanguardia, y consecuentes con los riesgos, algunos conocidos, otros ignorados.
Sin embargo, en una paciente la terapia parece haber sido contraproducente de una manera no vista con anterioridad.
La paciente, una joven de 20 años, sufría una variante de leucemia muy agresiva. El tratamiento de terapia celular alteró no solo las células T genéticamente modificadas, sino que también, inopinadamente, modificó los genes de «una» célula leucémica. Esta célula se tornó invisible a las células T programadas genéticamente contra el tumor. Partiendo de esta única célula el tumor resurgió y termino por causar la muerte de la paciente.
Este hallazgo, publicado en la revista Nature Medicine, avala una hipótesis asentada en la investigación sobre el cáncer: que una única célula maligna es suficiente para el desarrollo de un cáncer mortal.
Inicialmente la paciente tuvo una remisión total de su tumor. Sin embargo, esa única célula comenzó a multiplicarse de una manera exponencial dando lugar a un clon de miles de millones de células malignas genotípicamente idénticas causando una recaída del estado clínico de la paciente, que terminó falleciendo.
El tratamiento con células T-CAR se desarrolló conjuntamente entre la universidad de Pennsylvania, el Children’s Hospital de Philadelphia y la división biotecnológica Novartis AG. El tratamiento experimental se llevó a cabo en el contexto de un estudio clínico relativamente extenso.
El caso se considera excepcional, no habiéndose observado con terapias experimentales de otras compañías farmacéuticas.
Este caso es la antítesis de otro comunicado el pasado mes de mayo (2018) en el que una única célula T mutó espontáneamente y comenzó a multiplicarse de manera imparable, destruyendo el tumor de otro paciente.
La paciente sujeto del artículo, que terminó falleciendo, había sido diagnosticada de leucemia linfoblástica aguda. Fue tratada varias veces en el Children’s Hospital de Philadelphia, recayendo tras mejorías parciales después de diversos abordajes terapéuticos.
La paciente participaba en un estudio clínico que se inició en agosto de 2014.
Tras la recaída de la paciente, después del tratamiento con células T-CAR, los análisis mostraron que todas las células leucémicas se originaron a partir de una única célula leucémica mutada. Esta mutación permitió al clon formado a partir de ella soslayar el ataque por las células T-CAR modificadas genéticamente. Es el único caso descrito en el que una única célula leucémica muta causando una recaída mortal.
No obstante este contratiempo, la terapia celular (y otras formas de inmunoterapia) continúan siendo la mejor, y única, opción de tratamiento cuando los pacientes se han mostrado refractarios o han experimentado recidivas con otras alternativas farmacológicas (radioterapia, cirugía o quimioterapia).
Este hallazgo conduce a una aseveración apodíctica: la necesidad de individualizar los tratamientos, vigilando muy estrechamente la respuesta de cada enfermo. La terapia celular (al igual que otras formas de inmunoterapia) no puede, al menos de momento, estandarizarse, a semejanza de otros tratamientos «farmacológicos».
La terapia celular consiste en la exéresis de todas las células T del paciente, tratándolas ex vivo con un virus modificado que las «cargue genéticamente» para volverlas competentes frente al tumor. Las células T así modificadas se reinyectan en el paciente para que se enfrenten a las células tumorales.
Aun cuando se extreman las precauciones es casi imposible descartar que las células T aisladas no estén «contaminadas» con algunas células leucémicas. Tal vez ahí radique el problema que dio al traste, al menos en este caso, con el éxito inicial del tratamiento de la paciente.
La universidad de Pennsylvania vendió las regalías de su investigación, llevada a cabo por el grupo dirigido por Carl June, a la multinacional suiza Novartis AG., que logró la aprobación del tratamiento por la Food and Drug Administration (FDA) en agosto de 2017, con el nombre de Kymriah® (Tisagenlecleucel), la primera terapia génica contra el cáncer. El coste del tratamiento es de $475,000.
Novartis eludió cualquier responsabilidad arguyendo que la manipulación de las células T se realizó en la universidad de Pennsylvania, no en sus centros de procesamiento. En cualquier caso el laboratorio, que tiene registrado Kymriah®, ha creado un registro interno para llevar a cabo un seguimiento de todos los pacientes tratados durante los siguientes 15 años.
Zaragoza, a 5 de octubre de 2018
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Farmacia Las Fuentes
Zaragoza