Rosuvastatina es un medicamento hipocolesterolemiante del grupo de las estatinas (farmacológicamente: «inhibidores de la enzima hidroxi-metil-glutaril~CoA-reductasa», la enzima alostérica que cataliza la primera etapa en la síntesis hepática del colesterol).
Numerosos estudios epidemiológicos han consolidado la relación entre concentraciones de colesterol en plasma específicamente LDL[1]-colesterol, y el desarrollo de enfermedad cardíaca coronaria. [La aterosclerosis es el principal factor que desencadena la enfermedad de las arterias coronarias]. Por otra parte, la dislipidemia es uno de los muchos factores modificables vinculados con el ictus[2] y la enfermedad vascular periférica[3].
Los «inhibidores de la hidroxi-metil-glutaril~CoA-reductasa» constituyen, hoy por hoy, una piedra angular en el tratamiento de la hipercolesterolemia. Todas las estatinas son sosias farmacológicas de un intermediario de la reacción enzimática catalizada por la “hidroxi-metil-glutaril-CoA-reductasa”. El bloqueo de esta enzima imposibilita la síntesis de mevalonato, precursor en la biosíntesis hepática de colesterol.
La inhibición de la biosíntesis de colesterol es una de las aproximaciones terapéuticas más eficientes para disminuir las concentraciones de colesterol en plasma.
Todos los «inhibidores de la hidroxi-metil-glutaril~CoA-reductasa» disminuyen la incidencia de enfermedad cardíaca coronaria entre un 25 y un 60%. Se logra así una reducción de la mortandad global por causas cardiovasculares, de tipo primario y secundario.
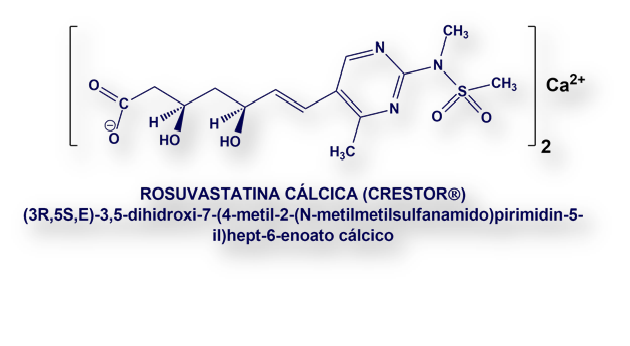
Rosuvastatina se formula como sal cálcica (ver estructura química al inicio del artículo).
Rosuvastatina es una de las estatinas «de elección» en el tratamiento de la hipercolesterolemia familiar heterocigótica u homocigótica.
Existen otros dos medicamentos para el tratamiento de la hipercolesterolemia familiar homocigótica: Lomitapide (Juxtapid®) que recibió la recomendación de autorización por parte de un comité asesor de la Food and Drug Administration norteamericana en octubre del año 2012; y Mipomersen (Kynamro®) autorizado en enero del año 2013. Mipomersen representa el primer medicamento que actúa a través de la tecnología del «ARN anti-sentido». Para mayor información sobre estos fármacos, consulte la página web http://www.info-farmacia.com/bioquimica/lafdaapruebakynamromipomersenparalahipercolesterolemiafamiliar.
CINÉTICA DE LA ROSUVASTATINA.-
Rosuvastatina es, después de la Pravastatina, la estatina más hidrófila.
Rosuvastatina muestra una relación lineal entre dosis, CMÁX., así como entre dosis y AUC24horas (estudios clínicos aleatorizados, controlados frente a placebo, y con doble ocultación, realizados en voluntarios sanos, en un rango muy amplio de dosificación, entre 20 y 80mg. La relación lineal anterior justifica que no se produzca acumulación de fármaco cuando se logran las concentraciones de estabilización (CSS), al cabo de 7 días de tratamiento, tal como se evidenció en estudios en que se usaron dosis diarias de 40mg, la posología prescrita de modo más usual. Con la posología de 40mg q.d.[4], la CSS ≈ 37mcg/L. La T1/2, β ≈ 20 horas; y la AUC24 ≈ 256mcg/L x hora.
 Rosuvastatina se metaboliza en una extensión muy limitada, habiéndose aislado un único metabolito, N-desmetil-Rosuvastatina (estudios in vitro). La administración de una dosis de 20mg de Rosuvastatina* (radiactiva) a seis voluntarios sanos mostró que aproximadamente el 90% del fármaco se recuperó en heces, y el 10% restante en orina. Del 90% recuperado en heces, 92% lo fue como Rosuvastatina sin metabolizar, y el 8% restante como Rosuvastatina N-desmetilada.
Rosuvastatina se metaboliza en una extensión muy limitada, habiéndose aislado un único metabolito, N-desmetil-Rosuvastatina (estudios in vitro). La administración de una dosis de 20mg de Rosuvastatina* (radiactiva) a seis voluntarios sanos mostró que aproximadamente el 90% del fármaco se recuperó en heces, y el 10% restante en orina. Del 90% recuperado en heces, 92% lo fue como Rosuvastatina sin metabolizar, y el 8% restante como Rosuvastatina N-desmetilada.
Dada su escasa metabolización, la cinética de Rosuvastatina no se afecta por el fallo hepático moderado (Child Pough clases A y B). Por la misma razón (escaso metabolismo hepático), Rosuvastatina tiene poca propensión a interacciones farmacológicas. Las potenciales interacciones y su importancia clínica deben consultarse en la siguiente página web de Atención Farmacéutica (www.farmacialasfuentes.com).
CONSIDERACIONES SOBRE ENSAYOS CLÍNICOS.-
El potencial hipocolesterolemiante de la Rosuvastatina se ha establecido en una serie de estudios clínicos multicéntricos, aleatorizados, con doble-ocultación, llevados a cabo en pacientes con concentraciones de LDL-Colesterol ≥160mg/dl e <250mg/dl [≥4,1mmol/L e <6,5mmol/L]. Los comparadores en estos ensayos clínicos fueron Atorvastatina, Pravastatina y Simvastatina.
Estudios adicionales han evaluado la eficacia de Rosuvastatina en pacientes con hipertrigliceridemia, con valores de triglicéridos[5] séricos ≥7,76mmol/L e <20,69mmol/L; habiéndose valorado también en dislipidemias mixtas (LDL-Colesterol ≈3,7mmol/L), hipercolesterolemia familiar homocigótica (LDL-Colesterol > 13mmol/L), e hipercolesterolemia familiar heterocigótica (LDL-Colesterol ≥5,69mmol/L e <12,93mmol/L). En estos estudios se usaron posologías entre 5mg q.d. y 80mg q.d. El punto final (endpoint) primario en estos estudios fue la concentración de LDL-Colesterol. Los puntos finales secundarios incluyeron las concentraciones de colesterol total, apolipoproteína-B, y triglicéridos. La duración de los diferentes estudios varió de 6 a 52 semanas.
TOLERANCIA DE LA ROSUVASTATINA.-
Diversos estudios clínicos (fase II y fase III) establecieron una incidencia de efectos secundarios comunes de 63,6%, distribuidos de la siguiente manera: faringitis (12,2%), dolor inespecífico (6,7%), cefalea (6,6%), sintomatología gripal (5,3%), y mialgia (5,1%). La incidencia y distribución de efectos secundarios fue similar entre los voluntarios sanos y entre pacientes con hipercolesterolemia, en distintos estadios del ensayo clínico. Por lo que respecta a estos efectos secundarios, la incidencia con Rosuvastatina fue similar a la notificada con otras estatinas (Pravastatina, Atorvastatina y Simvastatina).
Otros efectos adversos de la Rosuvastatina, comunes a todas las estatinas, incluyen diabetes mellitus, rabdomiolisis y nefrotoxicidad. Se comentan bajo el epígrafe siguiente.
VALORACIÓN GLOBAL DE LA ROSUVASTATINA.-
Rosuvastatina es la estatina más prescrita (agosto 2018). Solo en Estados Unidos se realizan 22,3 billones de prescripciones que representaron una facturación de más de 5 billones de dólares. A escala global la facturación de Rosuvastatina fue (año 2013) superior a 8 billones de dólares, siendo el tercer medicamento más prescrito en todo el mundo.
Rosuvastatina (Crestor®) se autorizó en Estados Unidos en el año 2003 con una indicación concreta: «disminución del colesterol en plasma». Otras tres estatinas (Simvastatina, Pravastatina y Lovastatina) se habían aprobado con anterioridad para «disminuir el riesgo cardiovascular»; y una cuarta estatina, Atorvastatina, evidenció «beneficio clínico» («disminución de riesgo cardiovascular») en el año 2004, un año después de comercializada la Rosuvastatina. La demostración de «disminución del riesgo cardiovascular» con Rosuvastatina no se confirmó (estudio JUPITER[6]) hasta el año 2010; y aun entonces, su indicación se circunscribió a la «prevención de ataques cardíacos e ictus». El aspecto más criticable del estudio JUPITER fue su pronta interrupción por los “excelentes resultados preliminares” [sic], tal vez exagerados deliberadamente.
Cuando Rosuvastatina se autorizó en el año 2010 para la «prevención primaria de ataques cardíacos e ictus», otras tres estatinas habían sido autorizadas tanto para la «prevención primaria» como para la «prevención secundaria» amparados por varios ensayos clínicos (cuatro en el caso de Atorvastatina; tres para la Pravastatina; y dos en el caso de la Simvastatina).
Los puntos finales (endpoints) en los estudios con Rosuvastatina fueron la evidencia de reducción del riesgo cardiovascular (beneficio) y la aparición de diabetes (efecto adverso asociado con todas las estatinas). Sorpresivamente, la incidencia de diabetes de nuevo cuño, era más elevada con Rosuvastatina (26%) en relación a la Pravastatina (7%)[7]. Estudios metabólicos han evidenciado que Rosuvastatina incrementa la hemoglobina glucosilada, los niveles de insulina en ayunas y la sensibilidad a la insulina, mientras Pravastatina muestra efectos opuestos (disminución de la hemoglobina glucosilada, de la insulinemia y de la sensibilidad tisular a la hormona insulina). La información técnica (prospecto) de Rosuvastatina indica que “la frecuencia de diabetes mellitus es del 2,8% en relación con 2,3% en los grupos placebo” [sic]. En cambio, con las demás estatinas la información técnica advierte de manera general de “un incremento de la hemoglobina glucosilada, así como de la glucemia en ayunas, un efecto adverso considerado «de grupo», característico de todos los «inhibidores del enzima hidroxi-metil-glutaril~CoA-reductasa».
Así pues, el riesgo de diabetes mellitus es significativamente más importante con Rosuvastatina en relación a las demás estatinas.
Otro efecto adverso «de grupo» es la rabdomiolisis[8] y, secundaria a ésta, la nefrotoxicidad.
La única estatina que dio lugar a casos de rabdomiolisis durante los estudios fase III (pre-comercialización) fue Rosuvastatina. Por esta misma razón, otra potencial estatina, Cerivastatina, fue retirada poco tiempo después de comercializarse.
Durante un estudio que involucró a más de 600.000 pacientes (exactamente: 641.703), un número significativo de participantes en el estudio mostraron concentraciones anormalmente elevadas de creatinina-fosfoquinasa. Estas concentraciones solo se obtenían tras la administración de otras estatinas (Simvastatina, Pravastatina y Atorvastatina) a dosis elevadas.
Por lo que respecta a la nefrotoxicidad, probablemente subsiguiente a la rabdomiolisis, Rosuvastatina es la única estatina que ha producido proteinuria y hematuria. La nefrotoxicidad puede derivar en Síndrome Nefrótico[9] y eventualmente en fracaso renal.
El argumento del fabricante y comercializador, AstraZeneca, avalado por la Food and Drug Administration norteamericana, es que estos efectos (rabdomiolisis y toxicidad renal) solo fueron significativos cuando se usaba la dosis más elevada de Rosuvastatina, de 80mg.
[1] LDL, acrónimo en inglés de Low Density Lipoproteins.
[2] Ictus: Interrupción del flujo de sangre en el cerebro. Puede desencadenarse por isquemia o hemorragia. El ictus hemorrágico suele derivar hacia ictus isquémico. Las consecuencias del bloqueo del flujo cerebral varían desde secuelas clínicamente imperceptibles a un cuadro de apoplejía con elevado riesgo de mortalidad y graves secuelas permanentes.
[3] Enfermedad vascular periférica: es un bloqueo del flujo sanguíneo en diversas partes del cuerpo, distintas del cerebro (ictus) que causan necrosis del tejido que pierde irrigación.
[4] q.d.: quaque in die (una vez al día).
[5] Triglicéridos: apócope de triacilglicéridos.
[6] JUPITER, acrónimo en inglés de Justification for the Use of statins in Primary prevention: an Intervention Trial Evaulating Rosuvastatin.
[7] Pravastatina está asociada al menor riesgo de diabetes de todas las estatinas comercializadas (julio 2016).
[8] Rabdomiolisis: lisis (disolución) del tejido muscular. Los subproductos de la degradación del músculo, entran en circulación sistémica, siendo tóxicos para la función renal.
[9] Síndrome Nefrótico: término genérico para un conjunto de patologías que comparten un incremento de la permeabilidad de los glomérulos renales. Se produce hematuria y proteinuria con hipoalbuminemia subsiguiente, ascitis, edema e hiperlipemia, alterándose los parámetros de coagulación.
Zaragoza, 21 de agosto de 2018
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Farmacia Las Fuentes
Zaragoza