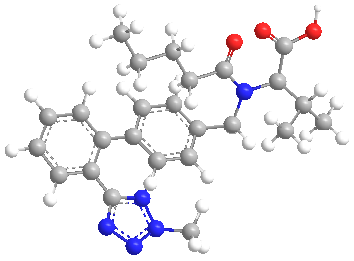
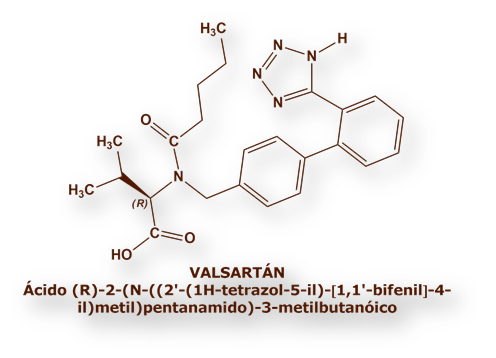
 Los Organismos Reguladores de Fármacos estadounidense y europeo (Food and Drug Administration, y European Medicine Agency, respectivamente) han ordenado la retirada de una serie de preparaciones farmacéuticas de distintos laboratorios conteniendo Valsartán como principio activo.
Los Organismos Reguladores de Fármacos estadounidense y europeo (Food and Drug Administration, y European Medicine Agency, respectivamente) han ordenado la retirada de una serie de preparaciones farmacéuticas de distintos laboratorios conteniendo Valsartán como principio activo.
Todas las preparaciones habían sido fabricadas en una única empresa de la República Popular China, Zhejiang Huahai Pharmaceutical, Co. Ltd. El motivo argüido para la retirada ha sido la presencia de N-nitroso-dimetilamina, un excipiente potencialmente cancerígeno. Aun cuando no se sabe por qué apareció la impureza, se achaca a una modificación del proceso de producción, y no a una contaminación externa accidental.
 El N-nitroso-dimetilamina, una nitrosoamina, es uno de los componentes que se producen al fumar cigarrillos (no cigarros), contribuyendo al efecto cancerígeno del consumo de tabaco.
El N-nitroso-dimetilamina, una nitrosoamina, es uno de los componentes que se producen al fumar cigarrillos (no cigarros), contribuyendo al efecto cancerígeno del consumo de tabaco.
La empresa china Zhejiang Huahai Pharmaceutical fabrica Valsartán para tres compañías farmacéuticas norteamericanas, Major Pharmaceuticals, Teva Pharmaceuticals Industries, y Solco Healthcare. Esta última empresa, propiedad de Huahai Pharmacéutical, casa matriz de la subsidiaria Zhejiang Huahai Pharmaceutical, Co. Ltd. tiene el 45% de todo el mercado norteamericano de Valsartán.
En España hay un significativo número de laboratorios afectados. La relación de los mismos se puede consultar en la Agencia Española del Medicamento y Productos Sanitarios (www.aemps.com) o ser solicitada a su farmacéutico.
Zhejiang Huahai Pharmaceutical se fundó en el año 1989. La empresa forma parte de la élite de las 500 más importantes de la República Popular China. Tiene 11 empresas subsidiarias, y cuenta en plantilla con 3.400 trabajadores. Su capitalización actual es de 1.900 millones de yuans [1€ equivale a 8 yuan chinos]. Además de Valsartán, también tiene una importante cuota de mercado de otros importantes medicamentos antihipertensivos, entre ellos Enalaprilo, Captoprilo y Lisinoprilo. Fue la primera empresa farmacéutica china que superó los exigentes estándares de calidad de la Food and Drug Administration norteamericana.
La decisión tomada tanto en Estados Unidos como en la Unión Europea ha sido la misma: retirar todos los lotes afectados para evitar cualquier riesgo potencial a los usuarios.
Las personas que tienen prescrito cualquier preparado conteniendo Valsartán como principio activo deben consultar, si no lo han hecho ya, con su farmacia. No obstante, no deben interrumpir su tratamiento. Los riesgos de no tomar la medicación son mayores que los asociados al contaminante que contienen los comprimidos. Es importante mencionar que no todos los fabricantes de preparados con Valsartán se han visto afectados.
La retirada de muchos preparados farmacéuticos con Valsartán tiene una amplia repercusión. No es vano es uno de los medicamentos antihipertensivos más prescritos. No obstante, existen múltiples alternativas de similar eficacia, y la sustitución del fármaco por otro del mismo grupo («Antagonistas del receptor de Angiotensina-II», o «ARA-II») no es problemática.
Con independencia de la rápida respuesta, es importante evaluar la presencia de esta sustancia (N-nitroso-dimetilamina) en otros preparados, así como evaluar el posible impacto que haya podido tener en los pacientes.
Esta situación debiera servir de reflexión acerca de derivación de la fabricación de un creciente número de medicamentos en países como China e India, en los que coexisten excelentes sistemas de producción con otros de muy dudosa fiabilidad.
Zaragoza, a 19 de julio de 2018
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Farmacia Las Fuentes
Zaragoza