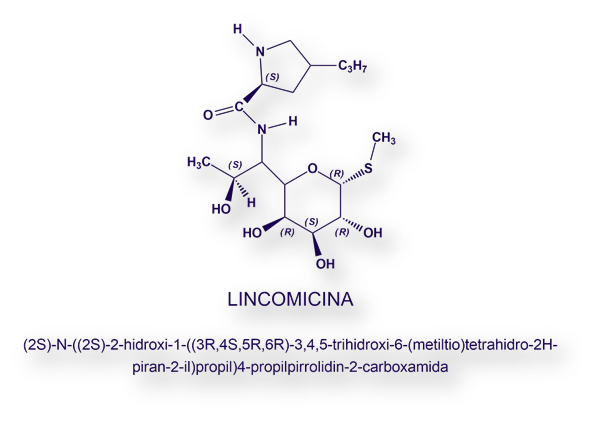
 La Lincomicina se aisló a partir de una cepa de Streptomyces linconlnensis[1] (en Lincoln, capital de Nebraska, Estados Unidos) como parte de un programa de investigación de microorganismos del suelo llevado a cabo por Upjohn Research Laboratories.
La Lincomicina se aisló a partir de una cepa de Streptomyces linconlnensis[1] (en Lincoln, capital de Nebraska, Estados Unidos) como parte de un programa de investigación de microorganismos del suelo llevado a cabo por Upjohn Research Laboratories.
A pesar de no guardar relación química con la Eritromicina, comparte con ésta, y el resto de los antibióticos macrólidos, su espectro antibacteriano.
 El único derivado de la Lincomicina que superó su farmacología fue la Clindamicina[2] (inicialmente denominado clinimicina).
El único derivado de la Lincomicina que superó su farmacología fue la Clindamicina[2] (inicialmente denominado clinimicina).
Espectro antibacteriano.-
Lincomicina y Clindamicina tienen espectros antibacterianos similares, si bien la Clindamicina tiene claras ventajas: espectro más amplio, mayor biodisponibilidad oral y la posibilidad de formulación parenteral. Ambos comparten con la Eritromicina (y el resto de los macrólidos) la actividad antibacteriana, pero con algunas diferencias.
Bacterias Gram positivas.-
La mayoría de las bacterias Gram positivas son susceptibles. Staphylococcus aureus, Staph. epidermidis, Streptococcus pyogenes, Strep. pneumoniae, Strep. viridans son sensibles, pero Streptococcus faecalis (sensible a la Eritromicina) es resistente frente a Lincosamina y Clindamicina.
Otros microorganismos (Clostridium diphtheriae y diversas especies de Nocardia) son también sensibles.
Entre los Gram positivos anaerobios, prácticamente todas las especies de Peptococcus, Peptostreptococcus, Eubacterium, Propionobacterium, Bifidobacterium y Lactobacillus, son susceptibles.
A semejanza de lo que sucede con Eritromicina, los estafilococos pueden adquirir un tipo de resistencia in vitro que puede transferirse al medio hospitalario. Como criterio general, Lincomicina (y Clindamicina) no se deben de prescribir para infecciones estafilocócicas que se muestran resistentes a la Eritromicina, aun cuando el antibiograma evidencia sensibilidad a Lincomicina y Clindamicina.
Los SAMR (Staphilococcus aureus meticilin-resistentes) se deben considerar refractarios tanto a Lincosamina como a Clindamicina, aunque algunas cepas puedan ser sensibles.
Gram negativos aerobios.-
De modo general, todas las bacterias Gram negativas aerobias son resistentes.
Gram negativas anaerobias.-
De modo general, todos los bacilos Gram negativos anaerobios son susceptibles.
Solamente el Cloranfenicol y el Metronidazol tienen un espectro de actividad frente a los anaerobios similar a la Lincomicina y Clindamicina.
Protozoos.-
La Clindamicina se ha mostrado eficaz en animales infectados por Plasmodium falciparum resistentes a la Cloroquina.
En base a todas las consideraciones previas, estos antibióticos, preferentemente Clindamicina (mejor espectro antibacteriano, biodisponibilidad y formulación parenteral) se usa en las siguientes infecciones clínicas:
- Infecciones estafilocócicas.
- Infecciones pneumocócicas y estreptocócicas.
- Infecciones por anaerobios Gram negativos.
- Difteria.
- Bronquitis crónica por Haemophilus influenzae.
- Acné.
- Septicemias fulminantes.
- Abscesos agudos.
- Endocarditis por fiebre Q.
- Malaria.
Mecanismo de acción.-
Estos antibióticos interactúan con el ribosoma bacteriano 50S bloqueando el inicio de la síntesis proteica.
Un estudio[3] mostró que Lincomicina y Clindamicina desrreprimen las β-lactamasas, hecho que podría explicar la resistencia de los bacilos Gram negativos.
Aspectos cinéticos [de la Clindamicina].-
La biodisponibilidad oral es de aproximadamente el 40%, con independencia de la presencia de alimentos en el tracto gastrointestinal. Las concentraciones máximas en suero se alcanzan al cabo de entre 1 y 2 horas de la administración. Las concentraciones siguiendo dosis de 600mg son más elevadas, pero no duplican, las obtenidas tras dosis de 300mg.
Los niveles séricos son más elevados en pacientes con celiaquía, diverticulosis o enfermedad de Crohn.
Siguiendo la administración (IV o IM) de la sal fosfato de Clindamicina (equivalente a 300mg de Clindamicina base) se obtienen niveles en suero de 4,9μg/ml al cabo de 2,5 horas, disminuyendo a 2,8μg/ml a las 8 horas de la inyección. [1μg = 10-3mg].
En pacientes diabéticos, tras la inyección IM, las concentraciones son más bajas de lo predecible (un efecto idéntico al observado con Penicilina G).
Tras una infusión IV de 30 minutos, las concentraciones en suero se hallan en un amplio rango: 2,6−26μ/ml (dosis de 300mg); y 6−29μg/ml (dosis de 600mg).
Excreción.-
Siguiendo una dosis per os de Clindamicina (bien en ayunas o junto con alimento), el 13% de la dosis administrada se recupera en orina durante las siguientes 24 horas; cifra que se reduce al 1% en pacientes con grave insuficiencia renal.
En pacientes con disfunción hepática, los riñones ejercen una excreción renal compensatoria.
La Clindamicina alcanza concentraciones significativas en bilis, si bien apenas el 5% del fármaco activo se recoge en heces.
En cualquier caso, el conjunto de la excreción renal y biliar no explica el destino de la dosis administrada, de lo que se infiere un importante metabolismo hepático, siendo N-desmetil-clindamicina y clindamicina-sulfóxido, los principales, pero no únicos, metabolitos.
El metabolismo hepático es notablemente más importante en niños.
Distribución tisular de la Clindamicina.-
Cuando se administra a las dosis recomendadas se alcanzan concentraciones adecuadas en muchos tejidos corporales, tales como pleura, peritoneo y tejido óseo, pero no en el líquido cefálico y raquídeo, excepto en caso de inflamación de las meninges (meningitis).
Los niveles del antibiótico en saliva, y en esputo de pacientes con infecciones purulentas son similares a los séricos.
Las concentraciones en bilis pueden duplicar o triplicar las séricas, salvo en caso de obstrucción biliar, siendo entonces indetectable su presencia en bilis.
Así mismo, la Clindamicina también difunde en el líquido ascítico de pacientes con peritonitis bacteriana; y en úlceras de decúbito.
Difunde a través de la placenta, alcanzando concentraciones en el cordón umbilical de aproximadamente la cuarta parte de las presentes en el suero materno.
Concentraciones sub-inhibitorias de Clindamicina promocionan (in vitro) la fagocitosis de Escherichia coli por leucocitos polimorfo-nucleares. También se ha demostrado que favorece otros mecanismos inmunitarios, como opsonización y fijación del complemento.
Su unión a proteínas plasmáticas es moderada, alrededor del 60%.
Toxicidad.-
El principal efecto adverso de ambos antibióticos, Lincomicina y Clindamicina, es la diarrea, que puede ser, bien auto-limitada, o la primera señal indicativa de colitis pseudomembranosa, que persiste 1 o 2 semanas tras la interrupción del tratamiento. La signología y sintomatología incluyen: profusa diarrea acuosa, espasmos abdominales, rectorragia con presencia de neutrófilos, megacolon tóxico y perforación intestinal potencialmente mortal. El efecto se puede producir con Lincomicina oral o parenteral, pero solo tras la administración parenteral de Clindamicina. El riesgo es más significativo cuando el paciente ha sido sometido a cirugía abdominal. En estas circunstancias se puede producir tras la administración oral o parenteral, y no está relacionado con la duración del tratamiento antibiótico.
La colitis pseudomembranosa no es una nueva enfermedad asociada con todos los antibióticos (excepto Vancomicina). Este cuadro clínico ya se presentaba en la era pre-antibiótica, generalmente asociado a la obstrucción del colon por presencia de un carcinoma, o como secuela de cirugía abdominal. En los cuadros de colitis pseudomembranosa es muy frecuente la colonización por Clostridium difficile.
Se han descrito también reacciones de hipersensibilidad, toxicidad hepática moderada y neutropenia.
La información anterior no es exhaustiva. Siempre hay que recurrir a la ficha técnica (prospecto) del medicamento, y a la información que obtenga directamente de su médico y farmacéutico.
Zaragoza, a 29 de septiembre de 2020
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Farmacia Las Fuentes
Florentino Ballesteros, 11-13
50002 Zaragoza
[1] Lewis C., et al. In vitro, and in vivo evaluation of Lincomycin, a new antibiotic. Antimicrob. Agents Chemother. 1963; 1962, p. 570.
[2] Magerlein B.J., et al. Chemical modification on Lyncomycin. Antimicrob. Agents Chemother. 1967; 1966, p.727.
[3] Sanders C.C., et al. Effects of Clindamycin of des-repression of β-lactamases in Gram negative bacteria. J. Antimicrob. Chemother. 1983; 12(Suppl C): 97.