Dos comités ad hoc de la Food and Drug Administration norteamericana (US-FDA) han emitido un informe favorable sobre un análogo de la Ketamina formulada en spray nasal para el tratamiento de la depresión. Se trataría del primer medicamento antidepresivo comercializado desde hace bastantes años.
La Ketamina adquirió popularidad en su uso clandestino durante la década de 1980 y 1990, bajo diversos nombres (Special K, y otros). Los usuarios refieren «experiencias extracorpóreas», técnicamente un cuadro psicótico.
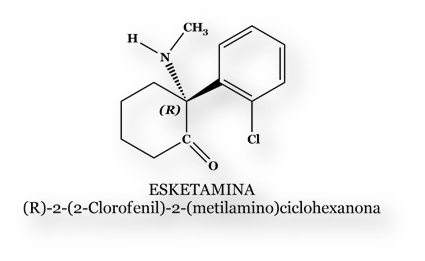 Esketamina ha sido desarrollada por el laboratorio Johnson & Johnson. Su indicación es el tratamiento de graves cuadros depresivos refractarios a la farmacoterapia convencional, y con un riesgo de suicidio tan importante que el paciente no puede esperar la demora asociada a los tratamientos antidepresivos clásicos. Los comités (Joint Meeting of the Psycopharmacology Drugs Advisory Committee, y Drugs Safety and Risk Management Advisory Committee) de los que formaron parte, entre otros, psiquiatras y representantes de los consumidores, consideró de modo casi unánime que los beneficios de la Esketamina superaban a los riesgos potenciales. Aunque no siempre, la Food and Drug Administration suele seguir las recomendaciones de sus comités asesores.
Esketamina ha sido desarrollada por el laboratorio Johnson & Johnson. Su indicación es el tratamiento de graves cuadros depresivos refractarios a la farmacoterapia convencional, y con un riesgo de suicidio tan importante que el paciente no puede esperar la demora asociada a los tratamientos antidepresivos clásicos. Los comités (Joint Meeting of the Psycopharmacology Drugs Advisory Committee, y Drugs Safety and Risk Management Advisory Committee) de los que formaron parte, entre otros, psiquiatras y representantes de los consumidores, consideró de modo casi unánime que los beneficios de la Esketamina superaban a los riesgos potenciales. Aunque no siempre, la Food and Drug Administration suele seguir las recomendaciones de sus comités asesores.
Durante los últimos años se han ofertado tratamientos para la depresión en los que se inyecta Ketamina intravenosa de un modo que remeda la terapia electroconvulsiva (electroshock). El paciente permanece ingresado varios días, durante los que recibe inyecciones intravenosas de Ketamina a un coste de más de 5.000 dólares la estancia. Estos tratamientos han de ser costeados por el paciente, ya que los seguros médicos no los incluyen en sus catálogos de prestaciones, al no estar aprobados por las autoridades sanitarias. Su efectividad no se ha estudiado de modo contrastado. Algunos pacientes refieren mejorías, aunque no siempre duraderas.
Recomendamos la lectura de las siguientes referencias bibliográficas:
- Machado-Vieira R., et al. Ketamine and the next generation of antidepressants with rapid onset of action. Pharmacol Ther 2009; 123: 143-50.
- Zarate C., et al. Glutaminergic modulators: the future of treating mood disorders? Harv Rev Psychiatry 2010; 18: 293-303.
Si se autoriza Esketamina formulado como spray nasal para administración en aerosol, la mayoría de las compañías de seguros médicos y los sistemas públicos de salud financiarían los tratamientos.
El interés en la Ketamina como potencial tratamiento antidepresivo se remonta al año 2006. Investigadores del National Institute of Mental Health, dirigidos por Carlos A. Zarate, informaron que 18 personas con depresión grave tratadas con inyecciones intravenosas de Ketamina mejoraron notoriamente al cabo de pocas horas. Los tratamientos con antidepresivos convencionales precisan varias semanas para que su beneficio clínico se haga evidente.
El descubrimiento de la acción terapéutica de la Ketamina en la depresión fue casual. De hecho este hallazgo fortuito ha reconducido varias líneas de investigación desde la serotonina hacia la función de la Ketamina en la química cerebral. En la actualidad no existe un modelo conceptual que explique la causa de la enfermedad depresiva.
Tras el informe favorable de los comités asesores, la Food and Drug Administration tiene hasta el 4 de marzo para tomar la decisión acerca de la aprobación de la Esketamina.
La multinacional británica AstraZeneca abandonó una línea de investigación con un análogo de la Ketamina por los pobres resultados de un ensayo clínico.
Ketamina está autorizada como anestésico, para administración intramuscular, IV Bolus o infusión IV. Da lugar a anestesia de disociación, con aumento del tono muscular. Mientras está anestesiado con Ketamina el paciente mantiene los ojos abiertos. Desde un punto de vista mecanístico la Ketamina es un antagonista del receptor NMDA (acrónimo de N-Metil-D-Aspartato). Aprovechando esta circunstancia, muchos médicos la utilizan off-label para tratar a pacientes con graves e incontrolables cuadros depresivos asociados a manifiestas tendencias suicidas. Cada sesión de administración de Ketamina intravenosa cuesta entre 300 y 1.000 dólares. Dado que el paciente debe permanecer ingresado durante varios días, el coste total supera los 5.000 dólares. Además, suele ser necesario repetir la administración con cierta frecuencia porque los resultados, nunca contrastados, no suelen ser perdurables. La dosis de Ketamina usada en el tratamiento de la depresión refractaria es de 500mcg/Kg. Cuando el paciente responde, el efecto se evidencia a las 2 horas aproximadamente de iniciar la perfusión de la Ketamina; y perdura, en el mejor de los casos, durante 2 semanas.
La administración de Ketamina no está exenta de riesgos: desde elevación de la presión arterial y aumento de la frecuencia cardíaca, a un deterioro a largo plazo de la función mental.
Las dosis antidepresivas de Ketamina (y su isómero levorrotatorio, Esketamina) son más bajas que las dosis usadas en anestesia; y las empleadas por los usuarios ilícitos del fármaco. Para evitar, o dificultar el riesgo de abuso, Esketamina se ha formulado en spray nasal.
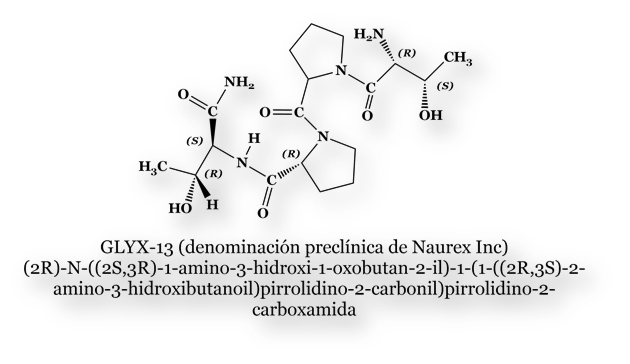 El laboratorio norteamericano Naurex Inc. ha desarrollado un medicamento experimental Rapastinel (GLYX-13), un agonista parcial del receptor NMDA (N-Metil-D-Asparato), que parece estar exento de los efectos adversos de tipo psicótico asociados al uso de Ketamina. El laboratorio, Naurex Inc. perteneciente en la actualidad Allergan, prevé solicitar la aprobación de este fármaco experimental a la Food and Drug Administration a lo largo del año 2019.
El laboratorio norteamericano Naurex Inc. ha desarrollado un medicamento experimental Rapastinel (GLYX-13), un agonista parcial del receptor NMDA (N-Metil-D-Asparato), que parece estar exento de los efectos adversos de tipo psicótico asociados al uso de Ketamina. El laboratorio, Naurex Inc. perteneciente en la actualidad Allergan, prevé solicitar la aprobación de este fármaco experimental a la Food and Drug Administration a lo largo del año 2019.
Además de Rapastinol (GLYX-13), Allergan también tiene en cartera otro potencial fármaco antidepresivo, con la denominación preclínica NRX-1074.
Zaragoza a 15 de febrero de 2019
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Farmacia Las Fuentes
Florentino Ballesteros, 11-13
50002 Zaragoza

