La escasez de vacunas contra enfermedades como la fiebre amarilla y la poliomielitis dio lugar a soluciones innovadoras en países muy pobres. En estos casos se trataba de sacar el mayor partido posible a la insuficiencia de vacunas. ¿Cómo se actuaba? Administrando dosis menores de las recomendadas, retrasando las segundas inyecciones (dosis «de refuerzo») y vacunando a grupos de población no relacionados geográfica o culturalmente, esto es, dispersando poblacionalmente la vacunación. La organización de origen francés Médicos sin Fronteras utilizó vacunas “para llevar”: durante los brotes epidémicos de cólera en Sudán del Sur. Los sanitarios administraron la primera dosis, entregando una segunda dosis para que cada persona la utilizase más tarde en su propio entorno. Esta situación tiene lógica en países donde muchas personas viven relativamente aisladas y las comunicaciones son muy deficientes. Esta práctica es efectiva cuando la primera dosis otorga una protección suficiente, y la segunda dosis solo es «de refuerzo» o potenciación de la primera dosis.
Los plazos para la vacunación contra el covid-19 se están incumpliendo en la mayoría de los países.
La táctica de vacunación (retrasada o fraccionada) ha funcionado con las vacunas contra la fiebre amarilla, la poliomielitis, sarampión, cólera y ébola. Todas estas vacunas (exceptuando la vacuna contra el virus ébola) se desarrollaron hace varias décadas, existiendo versiones para administración oral que se pueden conservar en un refrigerador convencional.
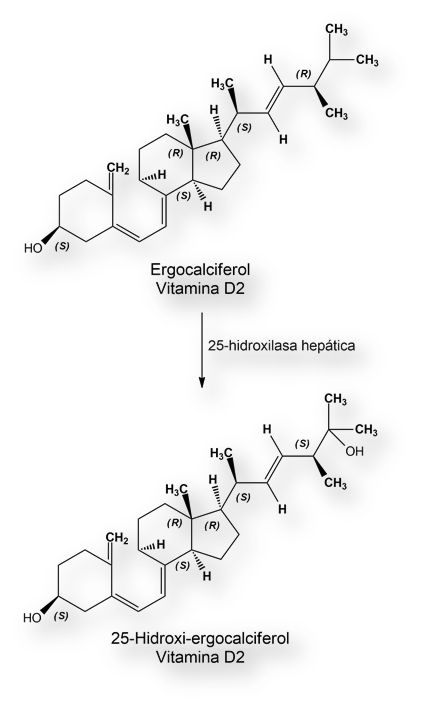
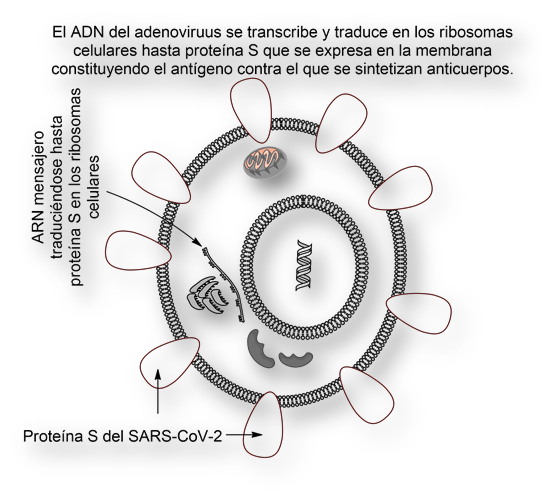
Las vacunas anti-covid-19 se fundamentan en ácidos nucleicos (ADN o ARN), por lo que son demasiado frágiles (termolábiles), y no se sabe la duración de la protección que confieren.
 Residentes de Kanyhunga, provincia de Kivu, República Democrática del Congo (antiguo Zaire) durante una campaña de vacunación contra el virus del Ébola en diciembre de 2018.
Residentes de Kanyhunga, provincia de Kivu, República Democrática del Congo (antiguo Zaire) durante una campaña de vacunación contra el virus del Ébola en diciembre de 2018.
Existen dos estrategias que podrían funcionar con las vacunas actuales [anti-covid-19], pero ambas tienen su «talón de Aquiles».
La primera surgió en el Reino Unido en diciembre (2020) cuando se produjo un importante aumento de la incidencia y gravedad del covid-19, en parte por la aparición de la cepa mutante B.1.1.7, mucho más contagiosa. Se planteó comercializar todas las vacunas que se hallasen en estadios finales de investigación con objeto de otorgar un algún grado de protección, aunque fuese modesta, asumiendo que la segunda dosis se podría retrasar hasta 12 semanas (tres veces más del tiempo recomendado por los fabricantes) y que para esta segunda dosis se podría ser de una vacuna diferente. Este argumento se basó en la positiva experiencia de Israel, tras la administración de 600.000 primeras dosis de la vacuna de Pfizer-BioNTech.
Sin embargo, varios virólogos británicos advirtieron que esta práctica podría favorecer la aparición de cepas resistentes. La Food and Drug Administration estadounidense (US-FDA) también se opuso a esta idea.
Moncef Slaoui, principal asesor de la Operation Warp Speed, desarrollada por la Administración del expresidente D. Trump para financiar a los laboratorios con proyectos viables de vacunas (algunas ya comercializadas), planteó que la administración de dosis únicas podrían estimular inadecuadamente el sistema inmunológico de tal manera que la infección posterior podría ser mucho más grave que si no se hubiesen vacunado. Sin embargo, algunos estudios limitados realizados en simios a los que tras una primera dosis se infectó deliberadamente de covid-19 no desarrollaron una infección más grave.
Para justificar su argumentación recordó un incidente durante la década de 1960, cuando una vacuna frente al «Virus Respiratorio Sincitial», causante de una grave neumonía infantil, fracasó. En algunos niños la vacuna parecía predisponer a sufrir una versión más grave de la infección.
Otro ejemplo de cómo una vacuna puede predisponer a sufrir una infección más grave en relación a niños naïve (no vacunados) es la observada con la vacuna Dengvaxia® contra el dengue, desarrollada por la multinacional francesa Sanofi Aventis, y comercializada apresuradamente (luego retirada) en Filipinas.
Una segunda estrategia, surgida bajo la presión sanitaria, en Reino Unido fue usar la mitad de la dosis de la vacuna desarrollada por Moderna Therapeutics. Algunos ensayos con esta vacuna han mostrado que las dosis de 50μg lograron una respuesta inmunitaria indistinguible de la obtenida con dosis de 100μg. Durante los ensayos clínicos, Moderna Therapeutics eligió la dosis más elevada, tanto para asegurar una respuesta adecuada como para incrementar la duración de la protección de la vacuna. Bajo la urgencia de la pandemia, la Food and Drug Administration debería aceptar la dosis más baja (50μg) en lugar de exigir estudios clínicos previos. En este sentido hay tantas opiniones favorables como contrarias a esta proposición.
Así mismo, durante los ensayos clínicos con la vacuna de Oxford-Astra-Zeneca la administración, por error de fabricación, de una dosis inicial demediada, mostró una protección superior en relación a la dosis completa (~90% vs ~62%).
Examinando ejemplos recientes…
Durante las epidemias de fiebre amarilla en Brasil y República Democrática del Congo se usaron dosis más bajas (hasta de una quinta parte) del contenido de los viales. Por ejemplo, una dosis completa de la vacuna contra la fiebre amarilla, desarrollada durante la década de 1930, ofrece protección de por vida, mientras una quinta parte de la dosis protege durante aproximadamente 1 año, lo que puede ser suficiente en una situación epidémica.
En el año 2018, alrededor de 25 millones de brasileños, incluidos los de las superpobladas ciudades de Rio de Janeiro y São Paulo se enfrentaron a un brote epidémico de fiebre amarilla, en un escenario con un stock mundial de menos de seis millones de dosis. El gobierno brasileño decidió administrar la quinta parte de la dosis, enviando equipos sanitarios móviles a barrios marginales y reduciendo la burocracia administrativa. La estrategia funcionó: si bien la vacuna tuvo un efecto limitado en el tiempo, se logró controlar la expansión de la epidemia.
Esta táctica se utilizó también contra la poliomielitis (polio). Desde el año 2016 hay escasez mundial de la vacuna inyectable formulada con virus muertos (de Jonas Salk) que en muchos países (España entre ellos) se usa conjuntamente con la vacuna oral a base de virus inactivados de Albert Sabin.
Aun cuando la polio ha desaparecido en los países desarrollados, se continúan notificando casos en países con rentas bajas, afectados por conflictos bélicos o fundamentalismo religioso contrario a la medicina occidental. La Organización Mundial de la Salud está implementando estrategias para incrementar el stock mundial de vacunas contra la polio.
India ensayó dosis demediadas de las vacunas contra la polio (información del Rotary International). Estudios ulteriores evidenciaron que la dosis se podía reducir a la quinta parte con la argucia de inyectarla por vía intradérmica en lugar de intramuscular.
 Las inyecciones intradérmicas se usan para la vacunación contra la rabia y la tuberculosis. Hace una década, Sanofi Aventis comercializó una vacuna antigripal para inyección intradérmica pero tuvo muy escasa aceptación tanto por el estamento médico como por los pacientes.
Las inyecciones intradérmicas se usan para la vacunación contra la rabia y la tuberculosis. Hace una década, Sanofi Aventis comercializó una vacuna antigripal para inyección intradérmica pero tuvo muy escasa aceptación tanto por el estamento médico como por los pacientes.
Las inyecciones intradérmicas de las vacunas optimizan las dosis por la abundancia de ganglios linfáticos bajo la piel. No obstante, la inyección intradérmica exige más habilidad para realizarlo correctamente. Al objeto de solventar ese inconveniente existen dispositivos de angulación de las agujas, y parches dérmicos con micro-agujas que liberan el contenido del parche. Este tipo de parches podrían facilitar al auto-vacunación.
Las inyecciones intradérmicas son más propensas (que las intramusculares) a desarrollar reacciones inmunes, dejando costras en el lugar de inyección. Esto solía ocurrir durante la vacunación contra la viruela antes de que se abandonase esta práctica en el año 1972.
La presencia de nano-partículas en las vacunas [anti-covid-19] de Pfizer-BioNTech y Moderna Therapeutics, las hacen propensas a esta reacción adversa (micro-hemorragias y costras en el lugar de inyección).
En el año 2017 United Nation Children’s Fund reclutó a 190.000 vacunadores para administrar vacunas contra la polio a 116 millones de niños en una semana. En otro eficaz programa, Nigeria (el país más poblado de África) vacunó contra el sarampión a casi cinco millones de niños en una semana.
En muchos aspectos, África está enseñando a Occidente cómo se pueden llevar a cabo ambiciosos programas sanitarios en muy poco tiempo.
Zaragoza, a 3 de febrero de 2021
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Farmacia Las Fuentes
Zaragoza