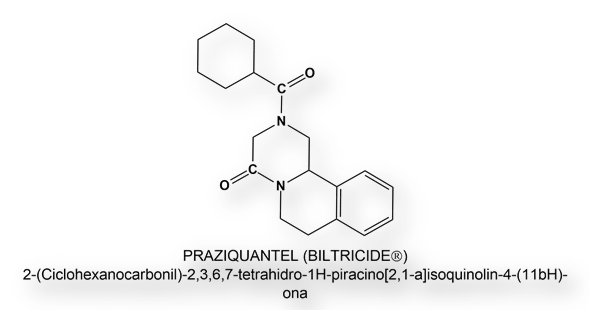
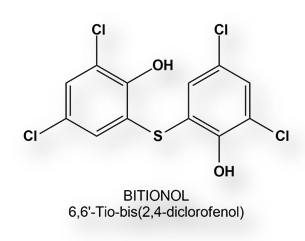
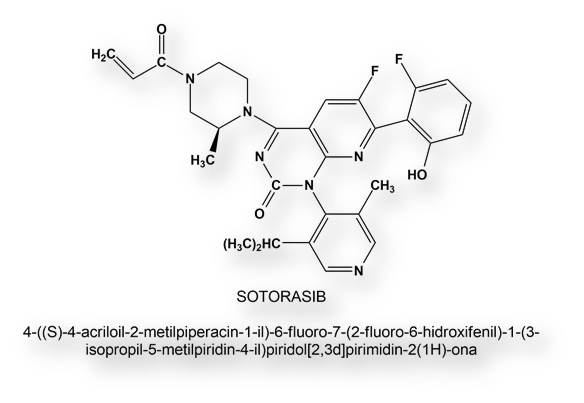
Administración de la primera dosis de la vacuna de Oxford-Astra-Zeneca a Prayuth Chan (66 años), Primer Ministro de Tailandia. Su vacunación fue transmitida online.
La interrupción de la campaña de vacunación anti-covid-19 con la vacuna de Oxford-Astra-Zeneca (ChAdOx1 n-CoV-19, también designada AZD1222) en la mayoría de los países de Europa supone un grave trastorno en la lucha contra la pandemia.
Contrariamente a lo repetido por los gobiernos de los países de la Unión Europea, es prácticamente imposible que el 70% de la población europea se haya vacunado contra el covid-19 antes del próximo mes de septiembre. Gran parte de la población europea sufre restricciones extremas en su quehacer diario, con gravísimo quebranto social, anímico y económico. Además, existe un creciente temor ante una posible tercera (cuarta según algunas opiniones) oleada de la pandemia.
La razón para la suspensión de la administración de la vacuna de Oxford-Astra-Zeneca se debe a la aparición de trombosis y embolias, una patología enormemente inusual en personas de menos de 55 años, el límite de edad impuesto por las autoridades sanitarias para la inoculación de esta vacuna, si bien en fechas recientes se amplió la edad máxima para la vacunación hasta los 65 años.
La Agencia Europea del Medicamento (EMA, de su acrónimo en inglés, European Medicine Agency) ha declarado su preocupación por los potenciales efectos adversos (trombosis) notificados en algunas personas vacunadas. Sin embargo, Emer Cooke, director ejecutivo de la EMA ha puesto en duda que exista una relación causal entre la vacuna y las trombosis notificadas. En una conferencia de prensa añadió: …si bien la investigación sigue su curso, estamos [los responsables de la EMA] convencidos que los beneficios de la vacuna [de Oxford-Astra-Zeneca] para prevenir la infección covid-19, sobre todo en su forma más grave, superan los potenciales efectos adversos”.
De momento la interrupción de la vacunación ha generado inquietud entre decenas de millones de personas que, de momento, verán retrasada la segunda dosis de la vacuna, mientras se teme una tercera (o, cuarta) ola pandémica.
Las decisiones de la Unión Europea en materia de vacunas se han caracterizado por mezquindad política, mensajes contradictorios, cuando no claramente engañosos, escasez de suministro y falta de solidaridad entre naciones. Además, la estrategia de vacunación intracomunitaria [de la Unión Europea] se ha centrado en la vacuna desarrollada por Oxford-Astra-Zeneca (no olvidemos que se trata de la vacuna europea).
La posible reanudación de la vacunación está a expensas de la difícil decisión que en un plazo de muy pocos días (finales de marzo) habrá de tomar la Agencia Europea del Medicamento.
Mientras tanto, la Organización Mundial de la Salud, al objeto de evitar el pánico, reafirma la seguridad de la vacuna, al no hallar una relación indubitada entre la vacunación y efectos adversos graves, sobre todo el relacionado con posible trombosis.
La esperanza radica en que millones de personas se han vacunado sin experimentar efectos adversos importantes. Además, los ensayos clínicos previos a su autorización tampoco evidenciaron efectos nocivos significativos.
El laboratorio sueco-británico Astra-Zeneca fabricó alrededor de dos mil millones de dosis destinadas a más de setenta países. La vacuna se vende a precio de coste (sin ánimo de lucro), es mucho más barata que otras vacunas, no es tan exigente en su conservación, habiéndose enviado a países con bajos ingresos adheridos al programa mundial de intercambio de vacunas Covax.
Hasta el día 14 (marzo) la Unión Europea disponía de alrededor de ocho millones de dosis de la vacuna sin utilizar (datos del European Centre for Disease Prevention and Control). Los 27 países de la Unión Europea (junto con Suiza e Islandia) habían inyectado la vacuna a 42 millones de personas aproximadamente.
A título de comparación, en Estados Unidos (donde la vacuna de Oxford-Astra-Zeneca no ha sido aprobada) se vacuna diariamente a 2,4 millones de personas; y el número total de vacunados (con las dos dosis de las vacunas de Pfizer-BioNTech o Moderna Therapeutics) supera ya los 100 millones, aproximadamente la tercera parte de la población. Muy recientemente han aprobado la vacuna de Johnson and Johnson, que solo requiere una inoculación.
Cuando se redacta este texto (16 de marzo, 2021) Astra-Zeneca todavía no ha presentado solicitud de autorización al Organismo regulador estadounidense, la Food and Drug Administration, más conocido por su acrónimo FDA.
En contraposición a la decisión europea de dejar en suspenso la vacunación, Tailandia ha iniciado un programa para la vacunación masiva de toda su población, siendo el Primer Ministro el primer vacunado (véase fotografía al inicio del texto). Sin embargo, esto sucedió solo un día después de haber interrumpido el inicio de la campaña La sorpresiva decisión se justificó en la información recibida de la Organización Mundial de la Salud y de la propia European Medicine Agency.
Tailandia usa la vacuna de Oxford-Astra-Zeneca, junto con otra de fabricación propia, de la empresa tailandesa Siam Bioscience, que espera producir 61 millones de dosis a finales del presente año, 2021. Siam Bioscience también fabrica para Tailandia la vacuna de Oxford-Astra-Zeneca.
No solo Tailandia, también Australia e India (el tercer país más poblado del mundo) continúan usando la vacuna de Oxford-Astra-Zeneca. El laboratorio esgrime esta información para cuestionar la relación causal entre los coágulos de sangre y la administración de su vacuna.
Sin embargo, Indonesia (el segundo país más poblado del planeta) ha retrasado el inicio de la vacunación hasta que las dudas se resuelvan.
La vacuna de Oxford-Astra-Zeneca, cuyo empleo se ha autorizado en más de 70 países, es fundamental para naciones con rentas bajas, al ser más barata y menos exigente en los requisitos de conservación en frio.
Australia no ha interrumpido el programa de vacunación, al no tener constancia de ningún problema de coagulación entre la población vacunada. Astra-Zeneca es fundamental para la vacunación en Australia, donde se fabrican las 53,8 millones de dosis que el gobierno precisa.
Sucede lo mismo en India, donde la vacuna se produce en el propio país bajo el nombre registrado de Covishield®.
Zaragoza, a 17 de marzo de 2021
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Farmacia Las Fuentes
Zaragoza