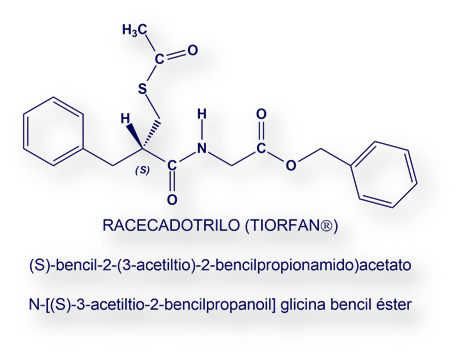
El 30 de septiembre (2016) falleció en Hillborough, California, Estados Unidos, Dale Schenk a la temprana edad de 59 años debido a un cáncer de páncreas. Desde el año 2012 era presidente y director ejecutivo de Prothena Corporation, una compañía biotecnológica asentada en Dublín, Irlanda. Durante su vida realizó trascendentes contribuciones a la investigación de la enfermedad de alzhéimer.
La enfermedad de alzhéimer es la más común y estudiada forma de demencia; continúa siendo un proceso neurodegenerativo irreversible. La farmacoterapia disponible hoy día apenas logra retrasar la evolución de la enfermedad en sus estadios iniciales.
Durante la década de 1990, Dale Schenk logró que la investigación para el tratamiento farmacológico de la enfermedad de alzhéimer virase desde los moduladores de la neurotransmisión hacia el desarrollo de “vacunas” contra las proteínas amiloideas que conforman depósitos cerebrales. [Se considera que la formación de placas de proteína β-amiloidea y estructuras neurofibrilares de proteína τ son las alteraciones estructurales que subyacen en el desarrollo de los signos y síntomas de la enfermedad neurodegenerativa]. Estos tratamientos se enmarcan en la «inmunoterapia de la enfermedad de alzhéimer».
La demencia de alzhéimer es, con algunas diferencias, la sexta causa de muerte en las sociedades desarrolladas. En España se estima que alrededor de 800.000 personas han sido diagnosticadas de demencia de alzhéimer, pero se piensa que el número real de casos será probablemente muy superior.
La inmunoterapia de la enfermedad de alzhéimer ha sido tomada con inusitado interés por la industria farmacéutica, si bien los resultados logrados hasta ahora han sido poco ilusionantes. De momento, la inmunoterapia no parece ser el talón de Aquiles de la enfermedad. No obstante, continúa siendo una de las áreas más dinámicas de investigación en farmacología.
En el año 1999, Dale Schenk dirigió un equipo de Elan Pharmaceuticals que publicó sus resultados en la revista Nature. Se administraron vacunas contra la proteína amiloidea en ratones modificados genéticamente de tal suerte que constituían un modelo de la enfermedad de alzhéimer humana. Las necropsias de los cerebros de ratones jóvenes no mostraban depósitos amiloideos. Por el contrario, los estudios histológicos de cerebros de ratones envejecidos evidenciaban numerosas placas amiloideas. La inmunoterapia daba lugar a una notable disminución de estos depósitos.
Este trabajo cambió los paradigmas de investigación en la enfermedad de alzhéimer. Varias empresas biotecnológicas crearon líneas de trabajo para el desarrollo de potenciales “vacunas” (anticuerpos contra epitopos antigénicos de proteína β-amiloidea).
La traslación de las observaciones con los ratones a los humanos no cumplió las enormes expectativas que se habían generado. Un ensayo clínico en humanos se interrumpió tras la muerte de dos pacientes como consecuencia de procesos inflamatorios cerebrales. En otros ensayos, las necropsias de los cerebros de los pacientes mostraban una disminución de los depósitos amiloideos, pero no se evidenció mejoría clínica alguna en los enfermos.
Se han producido otros resultados desalentadores. Sin embargo, se acaba de publicar un tratamiento de inmunoterapia que reduce los depósitos amiloideos y, al mismo tiempo, mejora los parámetros cognitivos de los pacientes. Ha sido el primer resultado esperanzador de esta nueva estrategia farmacológica.
Casualmente, Dale Schenk falleció el mismo día que otro prominente investigador de la enfermedad de alzhéimer, Allen Roses, quien mantenía puntos de vista discrepantes sobre la causa de la enfermedad. Allen Roses consideraba que los depósitos de proteína amiloidea no eran la causa de la enfermedad, sino uno de los signos que aparecían como consecuencia del proceso neurodegenerativo.
Dale Bernard Schenk había nacido el 10 de mayo de 1957 en Pasadena, California. Se doctoró en Farmacología en la Universidad de California, San Diego (Estados Unidos).
Dale B. Schenk cambió el ámbito académico por la industria, ocupando posiciones ejecutivas en Athena Neurosciences y Elan Pharmaceuticals.
Durante su estancia en Prothena, Dale Schenk llevó a cabo trabajos sobre la enfermedad de parkinson y otras patologías cerebrales relacionadas con la formación de depósitos de proteína amiloidea.
Incluso tras el diagnóstico de su grave enfermedad (cáncer de páncreas), Dale B. Schenk continuó trabajando hasta el final de su vida.
En el año 2001 recibió el American Academy of Neurology’s Potamkin Prize, que reconoce las investigaciones sobre la enfermedad de alzhéimer y otras patologías neurodegenerativas.
Zaragoza, 10 de octubre de 2016
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
FARMACIA LAS FUENTES
ZARAGOZA