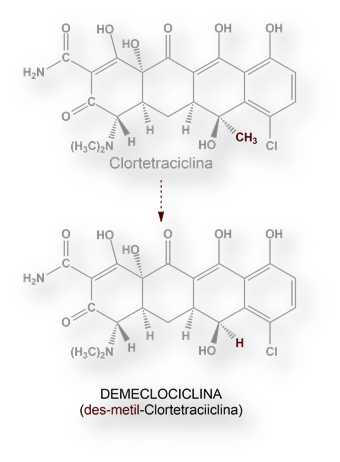
Los ensayos clínicos en amplios grupos de población han demostrado ser el mejor método empírico para evaluar la seguridad de los productos farmacéuticos.
Un estudio clínico con anticuerpos monoclonales para el tratamiento de la infección covid-19 ha sido desarrollado por el laboratorio Eli Lilly, cofinanciado por el gobierno federal estadounidense a través de los National Institutes of Health. Este estudio se ha interrumpido debido a problemas de seguridad (potential safety concern, sic). Este tipo de tratamiento es similar al que recibió el Presidente D. Trump durante su ingreso hospitalario tras contagiarse por covid-19, si bien en su caso se utilizó una combinación de anticuerpos monoclonales del laboratorio Regeneron Pharmaceuticals.
Este contratiempo sigue al de la multinacional Johnson & Johnson que días atrás se vio impelida a interrumpir el estudio clínico fase 3 de su potencial vacuna por «enfermedad inexplicable» en uno de sus voluntarios; y un mes después de que la multinacional sueco-británica Astra-Zeneca frenara el ensayo clínico de su vacuna debido a que dos participantes del grupo de estudio desarrollaran mielitis transversa, una grave enfermedad neurológica.
Sin embargo, los reguladores del estudio clínico de Astra-Zeneca de Brasil, India, Japón, Sudáfrica y Reino Unido permitieron su continuidad.
Mientras las interrupciones de los ensayos clínicos de nuevas vacunas es relativamente habitual, no lo es cuando se estudian nuevos tratamientos farmacológicos, sobre todo en pacientes gravemente enfermos.
El ensayo clínico [de Eli Lilly] designado con el acrónimo ACTIV–3 (Accelerating Covid-19 Therapeutic Interventions and Vaccines phase 3) se diseñó para ensayar anticuerpos monoclonales o combinaciones de éstos.
Este estudio es uno de los cuatro planificados por los National Institutes of Health a través de la Operation Warp Speed que si bien se pergeñó para estimular el desarrollo de vacunas contra covid-19, se ha ampliado a tratamientos farmacológicos contra la infección.
El estudio se lleva a cabo en hospitales seleccionados de todo el mundo.
Un ensayo clínico fase 2 (ACTIV-2), previo al actual, se diseñó para estudiar el anticuerpo monoclonal LY-CoV555, una IgG1 contra la proteína S (de Spike) del SARS-CoV-2, que se aisló a partir de muestras de sangre de un paciente que se recuperó de la infección. El aislamiento se llevó a cabo en AbCellera Biologics, en Vancouver, Columbia Británica, Canadá, en colaboración con NIAID’ s Vaccine Research Laboratories, y Eli Lilly & Company, de Estados Unidos.
El anticuerpo LY-CoV555 (ahora ya sintetizado en laboratorio como anticuerpo monoclonal) se está estudiando también en pacientes ambulatorios con síntomas leves a moderados de covid-19 (estudio ACTIV-2). El comité evaluador (Data Safety Monitoring Board) analiza los resultados de ambos estudios clínicos [ACTIV-2 y ACTIV-3], remodelando transaccionalmente cada uno de ellos en función de los resultados que se obtienen del otro.
Un objetivo prioritario de ambos estudios es delimitar los grupos de pacientes que podrían obtener un mayor beneficio.
El estudio ACTIV-3 se planteó inicialmente con 300 voluntarios hospitalizados por covid-19 con menos de 13 días de evolución. Los participantes se distribuyeron aleatoriamente en dos grupos: brazo de estudio, tratado con una infusión intravenosa de LY-CoV555, y grupo placebo, cuyos participantes reciben una infusión de solución salina fisiológica, farmacológicamente inocua. Todos los pacientes (grupo de estudio y grupo placebo) reciben Remdesivir como tratamiento de base para el covid-19. Al cabo de 5 días de iniciado el ensayo se lleva a cabo una primera valoración clínica, basada fundamentalmente en la necesidad de oxígeno suplementario o ventilación mecánica. Además, el estado clínico de todos los participantes se monitorizará durante 90 días.
La primera evaluación (a los 5 días de instaurar el tratamiento) fue determinante para extender el estudio clínico a otros 700 participantes voluntarios, siguiendo los mismos criterios de inclusión de los 300 primeros. El punto final (end point) será la recuperación clínica a los 14 días del alta hospitalaria.
El investigador principal de ACTIV-3 es el danés Jens Lundgren, de la universidad de Copenhague y el Rigshospitalet.
Eli Lilly ha comenzado también a estudiar (estudio clínico fase 3 BLAZE-1) la combinación de dos anticuerpos monoclonales: LY-CoV555 y LY-CoV016, ambos dirigidos contra la proteína S del SARS-CoV-2, pero interaccionando con epÍtopos de la proteína S (de Spike). Se valorará la reducción de la carga viral y la consiguiente necesidad de hospitalización. Se prevé contar con 800 participantes voluntarios. El estudio se inició el 17 de junio; la primera valoración parcial de los resultados: 20 de septiembre; y la finalización (estimativa) se prevé el 15 de enero de 2021.
En los extensos ensayos clínicos fase 3, los efectos adversos no son infrecuentes, y no siempre existe una relación causal con el fármaco (o la vacuna) estudiada. Un comité de expertos confirmará la relación causal antes de reanudar el estudio ACTIV-3 y aceptar la inscripción de nuevos voluntarios.
El estudio de Eli Lilly se detuvo cuando un comité independiente de evaluación observó un estado clínico distinto en los participantes tratados con anticuerpos (grupo de estudio) en relación a los incluidos en el grupo placebo. Las diferencias clínicas habían traspasado el umbral predeterminado de seguridad establecido previamente. Los pacientes del grupo de estudio recibieron 7 gramos del anticuerpo LY-CoV555, una dosis diez veces mayor que la prevista por el laboratorio para el tratamiento de los pacientes con covid-19 en régimen ambulatorio.
Uno de los criterios para la interrupción de cualquier ensayo clínico es la futilidad, esto es, la consideración de que un tratamiento tiene muy pocas probabilidades de funcionar. Otro criterio para la interrupción es que los pacientes de uno de los grupos (al ser ensayo «doble-ciego» no se sabe cuál es el grupo de estudio y cuál el grupo placebo) empeore su estado de salud de manera indubitada.
El comité de expertos (Data and Safety Monitoring Board) que supervisa el ensayo dictaminará el próximo 26 de octubre (2020) si se debe continuar o interrumpir el estudio clínico.
Eli Lilly, junto con Regeneron Pharmaceuticals, investigan la utilización de anticuerpos monoclonales como potencial tratamiento contra covid-19. Es una estrategia distinta, pero complementaria, a la de los laboratorios que tratan de desarrollar potenciales vacunas.
La experiencia de los anticuerpos monoclonales de Regeneron Pharmaceuticals con el Presidente estadounidense D. Trump ha motivado a los dos laboratorios que desarrollan anticuerpos monoclonales (Eli Lilly y Regeneron Pharmaceuticals) a solicitar a la Food and Drug Administration estadounidense (US-FDA) la autorización de sus productos usando alguna de las vías urgentes previstas en la legislación para los cuadros leves a moderados de covid-19.
El tratamiento con anticuerpos monoclonales se dirigiría a personas con sintomatología leve a moderada con objeto de controlar los síntomas antes de que su agravamiento comprometiese su supervivencia. Así pues, serían un tratamiento en el estadio temprano de la enfermedad.
Tal vez la selección de los pacientes a tratar con estos anticuerpos monoclonales sea fundamental para lograr los resultados óptimos. Quizás la administración a pacientes gravemente enfermos, lejos de lograr una mejoría, podrían incluso empeorar la situación clínica, activando la denominada «tormenta de citoquinas».
Zaragoza, a 16 de octubre de 2020
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Farmacia Las Fuentes
Florentino Ballesteros, 11-13
50002 Zaragoza