Paciente tuberculoso en el hospital Guwahata (Estado de Assam, India)
Cada año se notifican alrededor de 10 millones de nuevos casos de tuberculosis, con una mortandad superior a 4.000 personas diarias. En la actualidad es la principal causa de muerte de origen infeccioso en todo el mundo, Por ello, el desarrollo de una vacuna es una prioridad internacional.
Aun cuando la incidencia de tuberculosis disminuye lentamente en todo el mundo, hay tres países que contravienen esta tendencia general: Sudáfrica, Mozambique y Filipinas.
Aproximadamente la mitad de todos los casos (valores absolutos) de tuberculosis se circunscriben, en razón de su población y su extensión, a tres países: India, China y Rusia.
El surgimiento de cepas resistentes (MDR y XDR, acrónimos de Multi Drug Resistant, y eXtended Drug Resistant, respectivamente) ha conducido a una disminución del éxito de los tratamientos durante el último trienio: del 86% al 82%.
A partir del año 2015, la prevalencia de tuberculosis superó la del SIDA.
Una reciente publicación ha dado cuenta del desarrollo de una vacuna que, según la información preliminar, protege a una de cada dos contagiados frente al desarrollo de una tuberculosis activa. No es una protección excesiva, si se tiene en cuenta que la vacuna contra el sarampión protege al 98% de la población vacunada. Sin embargo, si tenemos en cuenta que 10 millones de personas se contagian cada año, de las que alrededor de un millón y medio fallecen, incluso una protección del 50% no es desdeñable. La Organización Mundial de la Salud, muy dada a las hipérboles, calificó la vacuna de «gran avance científico». A criterio de quien suscribe, es una exageración.
La nueva vacuna, desarrollada por GlaxoSmithKline en colaboración con Aeras Pharmaceuticals con la denominación preclínica de M72/AS01E se ha ensayado en un estudio clínico fase 2b en 3.300 adultos con tuberculosis latente, pero VIH negativos. de tres naciones de África: Kenia, Sudáfrica y Zambia. Los resultados muestran que la vacuna ha frenado el desarrollo de tuberculosis activa en el 54% de los participantes.
Se monitorizaron a todos los participantes en el estudio clínico durante tres años. Entre quienes recibieron dos dosis de la vacuna experimental, solo 13 desarrollaron tuberculosis activa, en contraste con 26 de un grupo de tamaño similar que recibieron placebo.
En función de su efectividad (aproximadamente 50%), la vacuna, ¿es una opción adecuada a la profilaxis antituberculosa actual que requiere una tanda de un mes de tratamiento antibiótico? Una razón para optar por esta vacuna es disminuir el riesgo de aparición de resistencias a los antibióticos.
Global Alliance Vaccines and Immunization (más conocida por su acrónimo GAVI) ha mostrado interés por esta vacuna.
Otras vacunas como la del papiloma vírico humano (que protege frente al desarrollo a largo plazo de tumores ginecológicos) tiene una protección estimada en un 70%; y una vacuna experimental contra la malaria, ensayada actualmente en entornos rurales de África, logra una protección que no supera el 39% (datos muy preliminares).
Bajo estas premisas, la pregunta es: ¿quién debería ser vacunado frente a la tuberculosis, bien para prevenir un primer contagio o, si se tiene una tuberculosis latente, para disminuir la probabilidad de que derive en una tuberculosis activa?
Un asunto trascendente es que aproximadamente una cuarta parte de la población mundial daría positivo (en un test de esputo o de sangre) a la tuberculosis latente, aun cuando nunca desarrolle la forma activa de la enfermedad. Esto significa que han estado expuestos a la micobacteria en algún momento de su vida. No obstante, la mayoría de las personas que desarrollan tuberculosis activa lo hacen en los dos años siguiente a un primer contagio. Esta conclusión se publicó en un trabajo de la revista médica British Medical Journal. Este estudio se acompañó de una editorial, publicada en el mismo número de la revista, escrito por Soumya Swaminathan en el que escribe que los aproximadamente 55 millones con riesgo más elevado de tuberculosis incluyen a niños pequeños con parientes contagiados, personas con grave desnutrición y/o inmunosupresión [por enfermedad o tratamiento farmacológico], e infectados con el virus VIH [un virus causante de grave inmunosupresión].
Se han llevado a cabo estudios de los distintos brotes de tuberculosis activa desde la década de 1930. Algunos, como los de las islas Feroe, en el Atlántico Norte (pertenecientes a Dinamarca) fueron paradigmáticos ya que al ser comunidades relativamente aisladas y reducidas, se pudo trazar un organigrama de los contagios.
Diversas organizaciones internacionales focalizadas en la lucha contra la tuberculosis (TB Alliance, e International Union Against Tuberculosis and Lung Disease) prefieren centrarse en el tratamiento de la tuberculosis activa, no tanto en las formas latentes o en la profilaxis.
Hay quien considera a los contagiados con el bacilo tuberculoso que no han evolucionado a la forma activa de la enfermedad, verdaderas «bombas retardadas». La genética puede explicar la evolución de la forma latente a la forma activa. En este sentido se recuerda el denominado «desastre de Lübeck», un desgraciado incidente en el área de las vacunas: en el año 1929, cuando doscientos cincuenta recién nacidos alemanes recibieron una vacuna contra la tuberculosis. La vacuna estaba contaminada accidentalmente con bacilos vivos. Una tercera parte de los niños falleció; el resto sufrió graves quebrantos médicos.
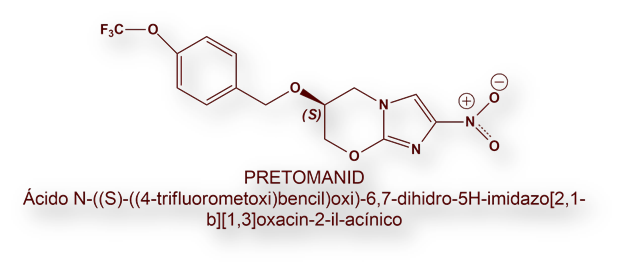
Los tres medicamentos más novedosos para el tratamiento de las cepas XDR (eXtended Drug Resistant) son Bedaquilina, Delamanida y Petromanid. El elevado coste de estos fármacos se trató en una reunión de Intellectual Property Watch en la que Sudáfrica, «Médicos Sin Fronteras», y Estados Unidos expusieron intereses contrapuestos. El gobierno sudafricano y la Organización No Gubernamental «Médicos Sin Fronteras», exigían la aplicación de una exención de los derechos de patente según una normativa de 1994, al objeto de que Sudáfrica (con una elevadísima prevalencia de la enfermedad) pudiese surtirse de versiones genéricas, más baratas, de estos medicamentos fabricadas por laboratorios de India u otros países. Las conclusiones fueron eufemísticas, pero no se logró acuerdo alguno.
La Organización Mundial de la Salud ha redactado una guía de tratamiento para la tuberculosis multirresistente.
La vacuna está formulada con los antígenos 32A y 39A de Mycobacterium tuberculosis. La valoración definitiva está pendiente de la conclusión de un ensayo clínico fase 3, actualmente en curso. Se pretende que la vacuna pueda ser útil pre- y post-exposición a la micobacteria al objeto de reducir la prevalencia mundial, en la esperanza de que la tuberculosis deje de ser un problema de salud global a mediados de la década de 2030.
En opinión de Mario C. Raviglione, de la Universidad de Milán, Italia, que dirigió el W.H.O.’s Global Tuberculosis Programme de 2003 a 2017.la vacuna parece prometedora, en cualquier caso mucho mejor que la centenaria BCG (Bacilo Calmette-Guérin).
La vacuna formulada con el bacilo Calmette-Guérin (abreviadamente: BCG) (no autorizada por la Food and Drug Administration estadounidense), protege a los recién nacidos contra algunos tipos de tuberculosis, pero no a los adolescentes y adultos frente a la tuberculosis pulmonar.
Desde hace un lustro, la mortandad por tuberculosis supera la causada por SIDA (ver antes en este mismo texto).
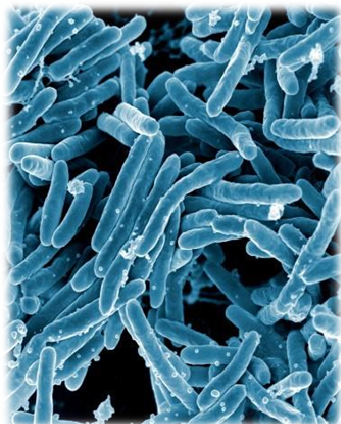 El microorganismo causante de la tuberculosis es Mycobacterium tuberculosis, conocido también como bacilo de Koch.
El microorganismo causante de la tuberculosis es Mycobacterium tuberculosis, conocido también como bacilo de Koch.
Los pacientes con tuberculosis activa sufren sudoración nocturna, fiebre, pérdida de peso, hemoptisis. La enfermedad no tratada tiene un elevado índice de mortalidad.
La tuberculosis se asocia con condiciones de hacinamiento y suciedad. Por ello la prevalencia varía sustancialmente en distintas comunidades, a veces muy próximas (por ejemplo, distintas zonas de una misma ciudad). El sol es muy dañino para la micobacteria, razón por la que se recomendaba a los pacientes tuberculosos tomar baños de sol en ambientes de aire puro (sanatorios en regiones montañosas).
El contagio suele producirse por proximidad con personas con tuberculosis latente o activa, incluyendo a los sanitarios que asisten a los enfermos. Las personas que viven en condiciones de hacinamiento en ambientes insanos son más propensas; así como, las personas tratadas con quimioterapia, malnutridas, sometidas a tratamiento inmunosupresor, diabetes, o que requieran diálisis.
Los expertos independientes y los del propio laboratorio (GlaxoSmithKline) comparten la opinión de que la vacuna necesita estudios más amplios, incluyendo pacientes con positividad para el VIH. Se deben realizar ensayos de distintas razas y grupos etarios, incluyendo a personas con negatividad en esputo y sangre para el bacilo de Koch.
Zaragoza, a 2 de noviembre de 2019
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Zaragoza