El viernes, 2 de noviembre de 2018, la Food and Drug Administration (FDA) norteamericana autorizó una nueva formulación de un potente analgésico, Sufentanilo, para el tratamiento del dolor agudo en personas adultas. La decisión de la FDA es contraria a la opinión del presidente del comité asesor a quien la FDA encargó el estudio previo de este fármaco con vistas a su aprobación. El presidente se manifestó contrario a la autorización debido al riesgo de abuso en un contexto de incremento del uso ilegal de potentes opiáceos, entre ellos Fentanilo, estrechamente relacionado con Sufentanilo. [Recordemos que la potencia, analgésica y adictiva, del Fentanilo es cien veces superior a la de la Morfina; siendo el Sufentanilo diez veces más potente que el Fentanilo, y consiguientemente 1.000 veces más potente que la Morfina].
El fármaco registrado con el nombre de Dsuvia®, fabricado y comercializado por AcelRx, es una formulación oral de Sufentanilo, un opioide sintético que, en formulación intravenosa, se ha venido utilizando en cirugía desde la década de 1980. El Fentanilo, químicamente muy relacionado con Sufentanilo, se utiliza en diversas preparaciones, desde inyectables, a parches transdérmicos y formulaciones bucodispersables. Desde hace unos años es uno de los medicamentos más utilizados ilegalmente siendo responsable de decenas de miles de muertes por sobredosis.
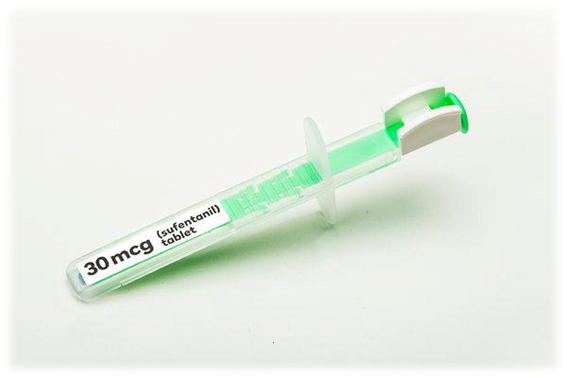
 En España, y resto de los países de la Unión Europea, Sufentanilo se comercializa en cartuchos para administración oral (véase imagen) conteniendo 15mcg de principio activo (en lugar de los 30mcg de la formulación de Dsuvia® en Estados Unidos). En la Unión Europa tiene el nombre registrado de Zalviso®, y es comercializado por el laboratorio alemán Chemie Grünenthal.
En España, y resto de los países de la Unión Europea, Sufentanilo se comercializa en cartuchos para administración oral (véase imagen) conteniendo 15mcg de principio activo (en lugar de los 30mcg de la formulación de Dsuvia® en Estados Unidos). En la Unión Europa tiene el nombre registrado de Zalviso®, y es comercializado por el laboratorio alemán Chemie Grünenthal.
Como se observa de las estructuras químicas, la única diferencia entre Fentanilo y Sufentanilo es la sustitución del grupo fenilo (Sufentanilo) por un heterociclo (tiofeno) en la molécula de Fentanilo.
Recomendamos la lectura complementaria de las siguientes referencias bibliográficas:
Fentanilo.-
- Formulación parches transdérmicos:
- Muijers R.B.R., Wagstaff A.J. Transdermal fentanyl: an update review of its pharmacological properties and therapeutic efficacy in chronic cancer pain control. Drugs 2001; 61: 2289-2307.
- Kornick C.A., et al. Benefit-risk assessment of transdermal fentanyl of transdermal fentanyl for the treatment of chronic pain. Drugs Safety 2003; 26: 951-73.
- Formulación oral transmucosa:
- Chwieduk C.M., Mckeage K. Fentanyl sublingual in breakthrough pain in opioid-tolerant adults with cancer. Drugs 2010; 70: 2281-8.
- Oral trans-mucosal fentanyl citrate. Med Lett Drugs Ther 1994; 36: 24-5.
- Anestesia:
- Jenstrup M., et al. Total IV anaesthesia with propofol-alfentanil or propofol-fentanyl. Anaesth 1990: 64: 717-22.
Sufentanilo.-
- Monk J.P., et al. Sufentanyl: a review of its pharmacological properties and therapeutic use. Drugs 1988; 36: 286-313.
Aun cuando el comité asesor encargado por la Food and Drug Administration recomendó (10 votos favorables, 3 contrarios) su aprobación, el responsable del comité, Raeford Brown, anestesista y docente en la universidad de Kentucky, en Lexington, escribió una carta al director del Organismo Regulador de Fármacos y Alimentos (FDA) expresando su disconformidad.
Raeford Brown ha firmado la carta junto a otros responsables del grupo de defensa de consumidores Public Citizen. En ella anticipa el riesgo de abuso de esta sustancia y de muertes asociadas a su empleo ilegal.
Tras la decisión de la Food and Drug Administration, Scott Gottlieb, en representación de la Agencia defendió la aprobación, haciendo énfasis en que la administración se realiza mediante un sistema de precarga (ver imagen al comienzo del artículo), y su utilización se restringe a hospitales quirúrgicos y otros centros especiales como Unidades de Cuidados Paliativos. Además su empleo puede ser muy útil para los soldados heridos durante conflictos bélicos, situaciones en las que es muy difícil el manejo de preparaciones inyectables.
Dsuvia® (Sufentanilo) no se dispensará en farmacias. Solo se podrá administrar en entornos hospitalarios mediante dispensadores individualizados de dosis única. Se espera que este poderoso analgésico opioide contribuya a solucionar el problema del control del dolor más lacerante, a la vez que las restricciones de su distribución impidan la expansión de la «epidemia» de abuso de narcóticos.
La Food and Drug Administration exigirá estudios post-comercialización (ensayos clínicos fase IV) al objeto de evaluar la eficacia de la nueva presentación de Sufentanilo en un contexto real. En función de la experiencia, la autorización se podría revocar. El año pasado (2017) la FDA solicitó al fabricante de Opana ER® (Oxicodona), otro potente opioide, que retirase voluntariamente su producto del mercado farmacéutico debido al abuso de la sustancia, tras haber llevado a cabo modificaciones galénicas que dificultaban su empleo ilegal.
Vince Angotti, responsable ejecutivo de AcelRx ha declarado que la compañía farmacéutica llevará a cabo un exhaustivo programa de vigilancia de Dsuvia® (Sufentanilo) monitorizando su distribución y auditando su utilización para evitar cualquier uso fuera del cauce hospitalario.
La controversia sobre la autorización de Sufentanilo oral (Dsuvia®) surge tras la oleada de muertes por sobredosis de opiáceos en Estados Unidos: más de 40.000 durante el año 2017, 30.000 de ellas debidas al Fentanilo y otros opiáceos sintéticos. [Algunas estimaciones más recientes elevan el número de muertes por sobredosis con Fentanilo y otros opiáceos de síntesis a más de 72.000 personas] Esta situación ha hecho que muchos médicos sean reticentes a prescribir este tipo de medicamentos a pacientes que lo precisan. Como derivación, muchos pacientes encuentran dificultades para conseguir este tipo de medicamentos para controlar su dolor.
El Sufentanilo es tan potente que algunos usuarios ilegales de la formulación intravenosa fallecen tras la primera inyección.
La experiencia enseña que las regulaciones establecidas por la Food and Drug Administration para evitar el uso clandestino de opioides no han funcionado. Una vez que un fármaco se comercializa, el control es muy difícil.
Varios senadores demócratas cuestionaron que el presidente del comité asesor no se hallaba presente cuando se llevó a cabo la votación. Recordemos que el resultado (10 vs 3) fue favorable a la autorización para la comercialización de Dsuvia®. El grupo de senadores solicitó que el Drug Safety and Risk Management Advisory Committee se involucrase en la decisión final. Aun cuando las decisiones de los comités asesores no son vinculantes, la Food and Drug Administration suele seguir sus recomendaciones, aunque existen excepciones.
Zaragoza, a 9 de noviembre de 2018
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Farmacia Las Fuentes
Florentino Ballesteros, 11-13
50002 Zaragoza