La Agencia Europea de Medicinas (EMA, de European Medicine Agency) ha recibido (noviembre de 2018) el informe favorable del CMHP (Committee of Medicinal Products for Human Use), su comité asesor, sobre el fármaco Fexinidazol para el tratamiento per os de la tripanosomiasis africana, más conocida como «enfermedad del sueño». Este derivado imidazólico promete ser un
La Agencia Europea de Medicinas (EMA, de European Medicine Agency) ha recibido (noviembre de 2018) el informe favorable del CMHP (Committee of Medicinal Products for Human Use), su comité asesor, sobre el fármaco Fexinidazol para el tratamiento per os de la tripanosomiasis africana, más conocida como «enfermedad del sueño». Este derivado imidazólico promete ser un
avance espectacular con vistas a la erradicación de esta terrible enfermedad.
A falta del informe definitivo de EPAR (European Public Assessment Report) – no hecho público cuando se redacta este informe, 22 de noviembre de 2018), la información disponible sobre Fexinidazol es la siguiente:
 Fexinidazol (ver estructura química al comienzo del texto) ejerce efectos tóxicos indirectos, induciendo mutaciones en las formas tripomastigote y epimastigote de los tripanosomas (consultar ciclo biológico en cualquier texto de Parasitología).
Fexinidazol (ver estructura química al comienzo del texto) ejerce efectos tóxicos indirectos, induciendo mutaciones en las formas tripomastigote y epimastigote de los tripanosomas (consultar ciclo biológico en cualquier texto de Parasitología).
Un tratamiento a base de dosis de 600mg diarios administradas durante 10 días consecutivos es resolutivo en los dos estadios (hematológico-linfático, y cerebral) de la tripanosomiasis africana («enfermedad del sueño»).
La eficacia de Fexinidazol 600mg se establece en base a dos criterios:
- No detección de formas parasitarias en sangre y fluidos corporales.
- Recuento leucocitario en fluido cerebroespinal ≤ 20 células/mcl [mcl = μl].
La indicación de Fexinidazol es el tratamiento de los dos estadios (hemático-linfático y meníngeo-encefálico) de la tripanosomiasis humana africana causada por infección con Trypanosoma brucei-gambiense en adultos, y niños de ≥ 6 años y ≥ 20Kg de peso.
Los efectos adversos notificados durante los ensayos clínicos han sido: náuseas, vómitos, astenia, vértigo, insomnio y temblor.
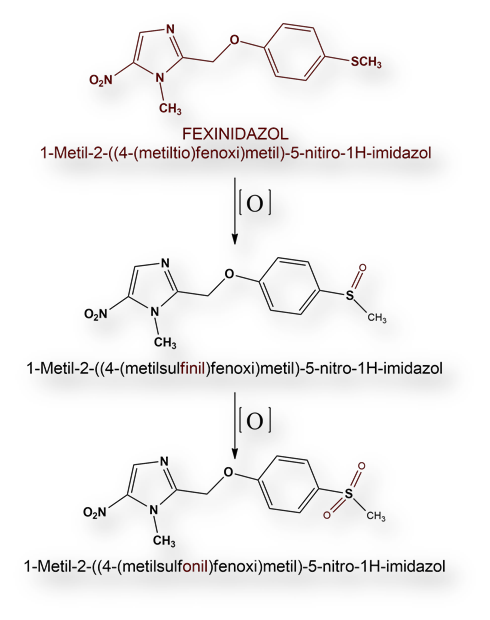 Se metaboliza mediante oxidación hasta dos metabolitos inactivos, que se excretan por ruta renal, sin aparente toxicidad.
Se metaboliza mediante oxidación hasta dos metabolitos inactivos, que se excretan por ruta renal, sin aparente toxicidad.
La «enfermedad del sueño» (tripanosomiasis) es una parasitosis causada por diversas especies protozoarias del género Trypanosoma. El parásito se transmite mediante las picaduras de la denominada mosca tsé-tsé La fotografía que acompaña el texto muestra una hembra preñada de mosca tsé-tsé (bajo esta denominación se engloban diversas especies del género zoológico Glossina).
El cuadro clínico de la tripanosomiasis deriva hacia una afectación cerebral que remeda a la sintomatología de la rabia en estadios terminales. La «enfermedad del sueño» es una denominación que falsea la terrible sintomatología que acompaña al cuadro clínico, sobre todo en las fases terminales, cuando ya existe afectación cerebral. Cuando los parásitos han invadido el tejido nervioso, las víctimas sufren alucinaciones, tornándose muy agresivos (sintomatología psicótica), con insoportable dolor al contacto con el agua (incluso su propio sudor). En esta fase la sintomatología remeda a la de la rabia. Solo al final, se entra en un estado de lasitud comatoso que antecede a la muerte.
 El Committee for Medicinal Products for Human Use (más conocido por su acrónimo CMPH), que asesora a la Comisión Europa, organismo dependiente de la Unión Europea, ha recomendado la fabricación, distribución y uso de Fexinidazol en pacientes con tripanosomiasis africana. La recomendación se ha tomado en vista de los resultados preliminares, anticipándose a la conclusión del ensayo clínico en curso, en el que participan 170 pacientes, previsto para marzo de 2020.
El Committee for Medicinal Products for Human Use (más conocido por su acrónimo CMPH), que asesora a la Comisión Europa, organismo dependiente de la Unión Europea, ha recomendado la fabricación, distribución y uso de Fexinidazol en pacientes con tripanosomiasis africana. La recomendación se ha tomado en vista de los resultados preliminares, anticipándose a la conclusión del ensayo clínico en curso, en el que participan 170 pacientes, previsto para marzo de 2020.
Fexinidazol se sintetizó en Alemania (Hoechst AG) dentro de un programa de investigación de derivados imidazólicos durante la década de 1980 como potenciales fármacos antiparasitarios. La investigación se abandonó al no hallar entonces una posible aplicación clínica.
Ha sido redescubierto dentro de un programa de búsqueda de opciones terapéuticas para la «enfermedad del sueño» desarrollada por la organización DNDi, acrónimo de Drugs for Neglected Diseases institute. DNDi se ha ocupado del ensayo clínico realizado con pacientes de la República Democrática del Congo (antiguo Zaïre) y la República Centroafricana. La multinacional francesa Sanofi Aventis, en la que se integró Hoechst, llevará a cabo la fabricación y distribución del medicamento.
Hasta ahora, los pacientes a los que se detectaban formas parasitarias en su sangre debían someterse a una punción lumbar a fin de establecer si el parásito había penetrado en su sistema nervioso. Si la respuesta era afirmativa, el paciente precisaba ingreso hospitalario y un relativamente complejo tratamiento intravenoso (véase más adelante bajo el epígrafe «Tratamiento de las tripanosomiasis africanas» en este mismo texto).
Un tratamiento oral con este «nuevo» medicamento (Fexinidazol) en base a una única toma diaria se podría realizar en el ámbito rural africano. Ello supondría una enorme ventaja en el contexto de su utilización.
Hoy día los fármacos clásicos para el tratamiento de la tripanosomiasis africana son Eflornitina y Melarsoprol.
El tratamiento intravenoso conEflornitina se ha de administrar diluido en suero (fluidoterapia). Además de la necesidad de una infraestructura hospitalaria, el coste supone un inconveniente insalvable en muchas empobrecidas regiones africanas.
Melarsoprol otro fármaco de uso intravenoso, se ha venido empleando hasta hace aproximadamente una década. El preparado contiene arsénico en su composición (véase más adelante). Existía riesgo de convulsiones, era corrosivo para las venas, y causaba la muerte al 5% aproximadamente de los pacientes.
En declaraciones del Dr. Victor Kande, asesor del Ministerio de Salud de la República Democrática del Congo (antiguo Zaïre), supervisor de los ensayos clínicos con Fexinidazol, «un tratamiento oral [para la tripanosomiasis] ha sido un sueño durante décadas. (…) Es un gran avance en la lucha contra la enfermedad».
TRATAMIENTON DE LA TRIPANOSOMIASIS AFRICANA
En el año 2009, durante un programa de investigación de medicamentos antiparasitarios, la multinacional francesa Sanofi Aventis, en la que Hoechst se había integrado, reformuló la galénica de Fexinidazol para su empleo en la tripanosomiasis.
El coste de autorización, incluyendo los ensayos clínicos llevados a cabo sobre 750 pacientes de la República Democrática del Congo y la República Centroafricana, fue de 63 millones de dólares.
El coste fue financiado por siete países de la Unión Europea, la Fundación Bill and Melinda Gates, la organización Médicos Sin Fronteras y otros filántropos que aportaron cantidades menos significativas.
Alrededor de 65 millones de personas viven en áreas endémicas del África central y occidental, donde la especie más común es Trypanosoma brucei-gambiense. Otras especies de Trypanosoma están acantonadas en regiones aisladas del oriente y sur de África. En estos lugares, continúan siendo precisos los tratamientos más antiguos, y yatrogénicos. [Originalmente Trypanosoma brucei era la forma que afectaba a animales salvajes. Su cruce con Trypanosoma gambiense ha dado lugar a la especie Trypanosoma brucei-gambiense].
La tripanosomiasis africana está causada por dos especies (que algunos expertos consideran la misma): Trypanosoma brucei-gambiense (causante de la tripanosomiasis del África occidental) y Trypanosoma brucei-rhodesiense (tripanosomiasis del África oriental), identificadas en Gambia y Rodesia respectivamente [Rodesia cambió su nombre a Zimbabue tras la independencia del Reino Unido en 1980].
La primera detección del parásito de la «enfermedad del sueño» se produjo en muestras de sangre de un europeo que vivía en Gambia en 1901, a la que Dutton denominó un año después, 1902, como Trypanosoma gambiense. Unos años más tarde, en 1910, Stephens y Fantham identificaron «otra» especie a la que dieron el nombre de Trypanosoma rhodesiense.
Durante muchos años se ha luchado con denuedo y relativo éxito contra la «enfermedad del sueño». Entre los años 2000 y 2012 la prevalencia de la enfermedad en las áreas endémicas se redujo un73%. Este «éxito» movió a la Organización Mundial de la Salud a proponer su total erradicación en el año 2020. El objetivo es claramente inalcanzable si se considera que más de 13 millones de personas viven en áreas de alto riesgo de tripanosomiasis africana. [Considérese que la actual población de África es de aproximadamente 1.200 millones de personas distribuidos en 54 países].
La clínica de la infección por tripanosomas tiene dos estadios: una primera etapa en la que el parásito se reproduce en sangre, linfa y tejido subcutáneo, durante la que la sintomatología es relativamente inespecífica (fiebre, cefalea y artralgias); y un segundo estadio, tras la invasión del tejido cerebral, causando la grave sintomatología antes comentada (confusión, alucinaciones, psicosis, alteración del patrón de sueño, y reacción muy dolorosa al contacto de la piel con agua, incluido el propio sudor del paciente). Este estadio es casi siempre mortal: el paciente cae en un estado de lasitud, coma y muerte.
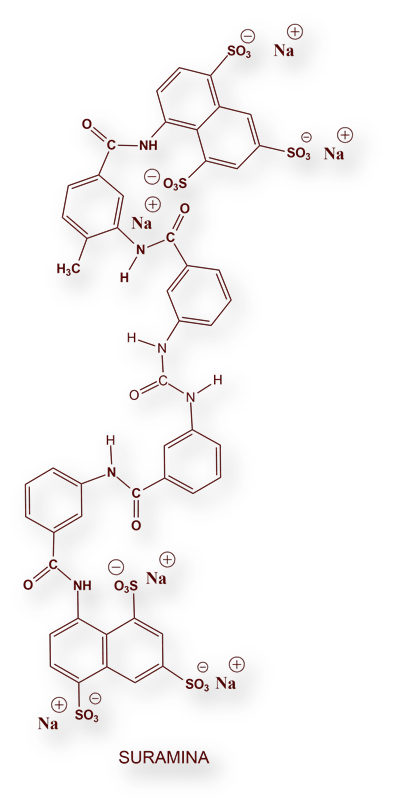
En la actualidad existen cinco medicamentos para el tratamiento de la tripanosomiasis: Suramina, Melarsoprol, Eflornitina, Nifurtimox y Fexinidazol.
Es la primera opción de tratamiento, durante la fase hemática-linfática de la «enfermedad del sueño», antes que los parásitos hayan penetrado en el sistema nervioso.
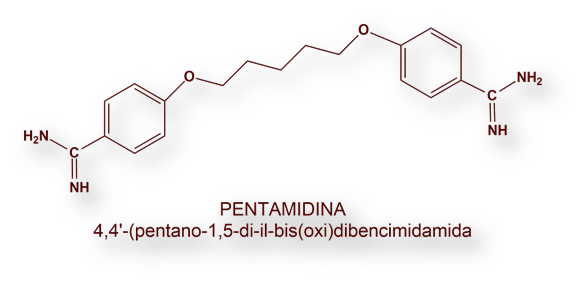
Cuando la Suramina no se puede administrar, o conseguir, la alternativa es Pentamidina.
La Pentamidina (Lomodine®) se viene utilizando desde 1941. Resurgió tras su reformulación, durante la pandemia del SIDA, comercializada como Pentacarinal®, por su relativa eficacia en las infecciones oportunistas por Pneumocystis carinii. Con la modificación galénica su precio se disparó de modo injustificado desde 1 dólar a más de 30 dólares por dosis.
Bayer fabrica la Suramina desde comienzos de la década de 1920. La Organización Mundial de la Salud ha conminado a Bayer para que continúe su producción. Se suele administrar en asociación con Pentamidina o Eflornitina.
Una importante limitación es que ambos fármacos se han de administrar por vía intravenosa. Además tienen numerosos efectos adversos que condicionan la aceptación por los pocos pacientes que tienen acceso a servicios hospitalarios.
Bibliografía recomendada sobre la Suramina asociada a Pentamidina o Eflornitina:
- Asociada a Pentamidina:
- Pépin J., Khonde N. Relapses following treatment of early stage Trypanosoma brucei-gambiense sleeping sickness with combination of Pentamidine and Suramine. R. Soc. Trop. Med. Hyg. 1996; 90: 183-6.
- Asociada a Eflornitina:
- Clerinx J., et al. Treatment of late stage rhodesiense tripanosomiasis using Suramine and Eflornithine: report of six cases. R. Soc. Trop. Med. Hyg. 1998; 92: 449-50.
 Fue el primer medicamento desarrollado específicamente para la tripanosomiasis africana, estando disponible desde 1949. Es eficaz tanto en la fase hemática como en la cerebral de la enfermedad. Sin embargo, es un compuesto arsenical, muy tóxico, causando a veces encefalopatías reactivas, y matando a 5 de cada 100 pacientes a quienes se les administra.
Fue el primer medicamento desarrollado específicamente para la tripanosomiasis africana, estando disponible desde 1949. Es eficaz tanto en la fase hemática como en la cerebral de la enfermedad. Sin embargo, es un compuesto arsenical, muy tóxico, causando a veces encefalopatías reactivas, y matando a 5 de cada 100 pacientes a quienes se les administra.
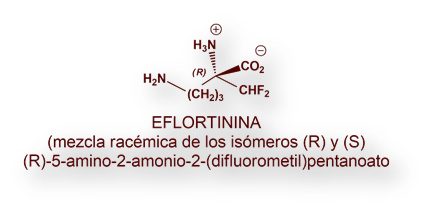 Eflornitina (también conocido como DFMO, acrónimo de Di-Fluoro-Metil-Ornitina), y registrado con el nombre de Ornydil®).-
Eflornitina (también conocido como DFMO, acrónimo de Di-Fluoro-Metil-Ornitina), y registrado con el nombre de Ornydil®).-
Su toxicidad es inferior a la del Melarsoprol y, al igual que ésta, eficaz en la tripanosomiasis con afectación cerebral. Eflornitina se comercializó en 1986 en la universidad de Pace, New York. El tratamiento con Eflornitina es muy complejo, sobre todo para un medicamento destinado al tratamiento de una enfermedad en países con muy escasos recursos sanitarios. Se requieren 56 infusiones intravenosas (4 veces al día durante 14 días). Cuando se comenzó a usar, las respuestas clínicas eran tan satisfactorias que se le denominaba como «la droga de la resurrección», dado que revertía a pacientes en estados comatosos.
A principios del año 2000 solo se disponían de 7.500 dosis en todo el mundo. El fabricante, Sanofi Aventis, había interrumpido su producción en el año 1995, debido al fracaso del fármaco como potencial anticancerígeno. Sin embargo, a finales de 2000 reformuló Eflornitina para uso tópico (Vaniqa®) dirigido al tratamiento de la hipertricosis facial femenina, tras un acuerdo comercial con la empresa Gillette.
Las críticas al laboratorio hicieron que reanudase su producción. Sanofi Aventis lo formuló en una preparación inyectable que regala a la organización Médicos Sin Fronteras para el tratamiento de la tripanosomiasis.
Bibliografía recomendada sobre Eflornitina.-
- Balasegariam M., al. Melarsoprol versus Eflornithine for treating late-stage Gambian tripanosomiasis in the Republic of Congo. Bull WHO 2006; 84: 783-91.
- Priotto G., et al. Safety and effectiveness of the first line Eflornithine for relapsing Trypanosoma brucei gambiense sleeping sickness in Sudan: cohort study. BMJ 2008: 336: 705-8.
- Mpia B., Pépin J. Combination of Eflornithine and Melarsaprol for Melarsaprol-resistant Gambian tripanosomiasis. Trop. Med. Int. Health 2002; 7: 775-9.
Nifurtimox.-
 Este fármaco, para uso oral, se comercializó en 2009, cinco lustros después del último fármaco para la tripanosomiasis, la Eflornitina. De hecho, ambos medicamentos (Eflornitina en infusión intravenosa, y Nifurtimox per os) se suelen usar juntos. No obstante, el tratamiento conjunto (Eflornitina y Nifurtimox) exige que se lleve a cabo en un entorno hospitalario.
Este fármaco, para uso oral, se comercializó en 2009, cinco lustros después del último fármaco para la tripanosomiasis, la Eflornitina. De hecho, ambos medicamentos (Eflornitina en infusión intravenosa, y Nifurtimox per os) se suelen usar juntos. No obstante, el tratamiento conjunto (Eflornitina y Nifurtimox) exige que se lleve a cabo en un entorno hospitalario.
Bibliografía sobre Nifurtimox:
- Pépin J., et al. High-dose Nifurtimox for arseno-resistant Trypanosoma brucei-gambiense sleeping sickness: an open trial in central Zaïre. R. Soc. Med. Hyg. 1992; 86: 254-6.
- Priotto G., et al. Nifurtimox-Eflornithine combination therapy for second stage African Trypanosoma brucei-gambiense tripanosomiasis: a multi-centre, randomised, phase III, non-inferiority trial. Lancet 2009; 374: 56-64.
El objetivo ha sido siempre hallar un medicamento por vía oral, relativamente atóxico, que haga posible el tratamiento en el medio rural.
Dos potenciales fármacos pueden cumplir con estas expectativas:
Acoziborol, y el antes comentado Fexinidazol.
 Acoziborol (SCYX-7158-designación preclínica, SCYX del laboratorio Scynexis, de North Caroline, Estados Unidos) se comenzó a evaluar en el año 2009, tras varios años de optimización del fármaco. Administrado en una única dosis se ha evidenciado seguro y efectivo en modelos experimentales en animales frente a un cuadro clínico homologable al de la tripanosomiasis humana. Acoziborol entró en la fase de investigación clínica a partir de 2012, siendo el primer fármaco en hacerlo en el ámbito del DNDi (Drugs for Neglected Diseases institute).
Acoziborol (SCYX-7158-designación preclínica, SCYX del laboratorio Scynexis, de North Caroline, Estados Unidos) se comenzó a evaluar en el año 2009, tras varios años de optimización del fármaco. Administrado en una única dosis se ha evidenciado seguro y efectivo en modelos experimentales en animales frente a un cuadro clínico homologable al de la tripanosomiasis humana. Acoziborol entró en la fase de investigación clínica a partir de 2012, siendo el primer fármaco en hacerlo en el ámbito del DNDi (Drugs for Neglected Diseases institute).
Los ensayos clínicos fase II/III se iniciaron en el cuarto trimestre de 2016. Participan 360 pacientes de siete lugares distintos de la República Democrática del Congo. Los pacientes toman tres dosis orales conteniendo 960mg de Acoziborol. Las conclusiones de los estudios se prevén para abril de 2020.
Según IMS Health, consultora del mercado farmacéutico, África, con más de 1.200 millones de habitantes, distribuidos en 54 países, solo utiliza el 1% de toda la producción mundial de medicamentos. En cambio, Norteamérica, Europa occidental y Japón, con un similar número de habitantes, consumen más del 80% de los fármacos mundiales.
La industria farmacéutica invierte anualmente alrededor de 27.000 millones de dólares en investigación, la mayor parte en medicamentos para las patologías usuales en el mundo desarrollado.
Zaragoza, a 22 de noviembre de 2018
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Farmacia Las Fuentes
Florentino Ballesteros, 11-13
50002 Zaragoza