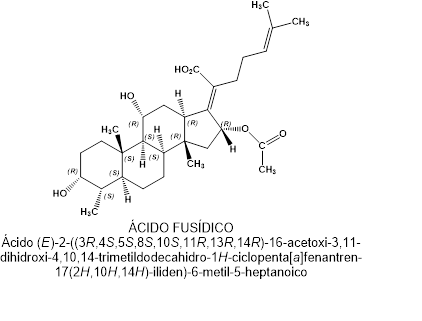
Los laboratorios Leo, en Copenague, Dinamarca, aislaron el ácido fusídico a partir del hongo Fusidium coccineum.
Ácido fusídico tiene una estructura esteroide (anillo de ciclopentanoperhidrofenantreno), si bien está relacionado con la cefalosporina P[1] aislado del hongo Cephalosporium acremonium.
Debido a su semejanza con la estructura de la prednisona, el ácido fusídico se consideró el primer representante de una nueva clase, los antibióticos esteroides. Sin embargo, no se han desarrollado nuevos antibióticos con la estructura química ciclopentanoperhidrofenantreno.
Todas las modificaciones estructurales realizadas sobre la molécula del ácido fusídico han conducido a derivados con menor actividad antimicrobiana.
Las diferentes formulaciones galénicas de ácido fusídico comercializadas en España (julio 2016) son:
- Comprimidos recubiertos conteniendo 250mg de ácido fusídico, formulado como su sal sódica
- Pomada[2] al 2%
- Crema[3] al 2%
- Gel oftalmológico al 1% (aplicación en el saco conjuntival)
MECANISMO DE ACCIÓN DEL ÁCIDO FUSÍDICO
A pesar de derivar estructuralmente de la cefalosporina P (notar que todas las cefalosporinas antibióticas derivan de la cefalosporina C), el ácido fusídico inhibe la síntesis de proteínas[4]. Consigue este efecto al evitar la translocación del Factor de Elongación (EF, de su acrónimo en inglés) desde el ribosoma. La unión del ácido fusídico al Factor de Elongación bloquea la translocación del aminoacil-ARNt al péptido en crecimiento. El ácido fusídico debe penetrar en la bacteria para ejercer su efecto. La resistencia de las bacterias Gram negativas al antibiótico se debe probablemente a que no atraviesa la pared celular[5].
El Factor de Elongación (más propiamente, los Factores de Elongación) tienen como función trasportar los aminoacil-ARNt hasta el ribosoma.
El proceso es el siguiente: el aminoacil-ARNt se inserta en el locus A del ribosoma. El aminoacil-ARNt que se una depende del codón del ARNm que ocupe el lugar A ribosómico. La sintetasa que ha catalizado la síntesis del aminoacil-ARNt transfiere el aminoácido a una proteína de 43 kd[6] denominada Factor de Elongación-Tu (EF-Tu, de su acrónimo Elongation Factor Thermo unstable). Es esta proteína la encargada de ubicar el aminoácido en el lugar A del ribosoma.
EF-Tu, se une al aminoacil-ARNt en su forma GTP. ¿Por qué? Hay dos razones: en primer lugar el Factor de Elongación-Tu (EF-Tu) protege de la hidrólisis el lábil enlace éster del aminoacil-ARNt desde que se libera del centro activo de la enzima sintetasa hasta que se sitúa en el locus A ribosómico. Y, en segundo lugar, la energía para la fijación del EF-Tu-aminoacil-ARNt al ribosoma procede de la hidrólisis GTP → GDP.
Existe un segundo Factor de Elongación (EF-Ts de su acrónimo Elongation Factor Thermo stable) cuya tarea es la disociación del EF-Tu-GDP, liberando el EF-Tu que, de esta guisa, se puede volver a unir a otra molécula de GTP e iniciar su función de acomodar otro aminoacil-ARNt en la cadena proteica en formación.
El ciclo GTP ↔ GDP del EF-Tu recuerda al de las proteínas G heterométricas en el proceso de transducción de señales, y al de las proteínas codificadas por el gen Ras[7] en el control del crecimiento. En todas estas proteínas (EF-Tu es también una proteína G) se produce un cambio de conformación entre las isoformas asociadas a GTP o GDP que condiciona la acomodación de una u otra proteína en el centro activo.
ADMINISTRACIÓN DEL ÁCIDO FUSÍDICO
El ácido fusídico se administra generalmente por vía oral. La dosis usual en pacientes adultos es de 0,5g cada 8 o 12 horas (hasta 1g cada 8 o 12 horas en infecciones graves). Se recomienda tomarlo junto con alimentos para evitar o reducir la dispepsia.
Las formulaciones orales más recientes se han traducido en una biodisponibilidad oral próxima al 100%. Las concentraciones en suero tras la administración oral son similares a las que se logran tras la administración intravenosa.
El ácido fusídico también se formula en pomada y crema al 2%; así como en un gel oftalmológico al 1% (administración en el saco conjuntival).
En España, y otros países, también existe una presentación que asocia ácido fusídico e hidrocortisona para uso tópico[8].
La pauta de administración en niños de hasta 1 año de edad de edad es la siguiente: 50mg/Kg-día, dividido en tres tomas (t.i.d.[9]). En niños de edades comprendidas entre 1 año y 5 años: 250mg t.i.d. A partir de 5 años, se usa la misma posología que en adultos (0,5mg t.i.d.).
No hay preparaciones tópicas especiales para niños, usándose las de los adultos y con idénticos protocolos de aplicación.
ÁCIDO FUSÍDICO EN INSUFICIENCIA RENAL
El ácido fusídico no precisa reajuste de dosis en caso de insuficiencia renal.
ÁCIDO FUSÍDICO EN INSUFICIENCIA HEPÁTICA
Los pacientes con colelitiasis tienen insuficiente cantidad de albúmina en suero. La mayor concentración sérica del antibiótico da lugar a un incremento de la difusión tisular, incluyendo la acumulación hepática. Se recomienda disminuir la dosis manteniendo la frecuencia de administración; o alternativamente mantener la dosis del fármaco espaciando la frecuencia de administración.
Por el contrario, en pacientes con bilirrubinemia, el ácido fusídico tiene menos competencia por los mecanismos enzimáticos de glucuronidación[10]. Así pues, el fármaco se metaboliza más deprisa.
En consecuencia, el ácido fusídico se puede administrar, incluso a dosis elevadas, a pacientes con bilirrubinemia; pero no a pacientes con insuficiencia hepática[11].
ADMINISTRACIÓN A PACIENTES ANCIANOS (>65 AÑOS)
La administración de ácido fusídico a ancianos da lugar a náusea con mayor frecuencia que en pacientes adultos. Se recomienda la administración de 500mg b.i.d.[12] (b.i.d., de bis in die, o “dos veces al día”).
BACTERIOLOGÍA DEL ÁCIDO FUSÍDICO
La principal característica del ácido fusídico es su elevada actividad frente a Staphylococcus aureus, incluyendo las cepas productoras de β-lactamasas, y las cepas meticilin-resistentes.
Staphylococcus epidermidis, incluyendo las cepas meticilin-resistentes, son también susceptibles al ácido fusídico.
Las bacterias Gram negativas son usualmente resistentes, a excepción de Neisseria spp., Legionella pneumophila y Bacteroides fragilis.
ÁCIDO FUSÍDICO FRENTE A BACTERIAS GRAM POSITIVAS
Las CIMs (Concentraciones Inhibitorias Mínimas) de Staphylococcus aureus susceptibles, otros staphylococi coagulasa-negativos y Streptococcus pneumoniae se hallan en el rango 0,016mcg/ml ↔ 0,5mcg/ml.
Las CIMs para Streptococcus pyogenes son superiores (1mcg/ml ↔ 16mcg/ml).
Las demás especies de Gram positivos son menos susceptibles (tienen CIMs superiores) en relación con Staphylococcus aureus.
Streptococcus pneumoniae solo es parcialmente resistente (CIM de 2mcg/ml).
Cocos anaerobios Gram positivos, tales como Peptococcus y Peptostreptococcus son susceptibles.
Otras bacterias Gram positivas, aerobias y anaerobias, tales como Corynebacterium diphtheriae, Clostridium tetanii y Clostridium perfringens son también susceptibles al ácido fusídico. Sin embargo, no todas las cepas de Clostridium difficile son susceptibles[13].
El ácido fusídico ha demostrado ser altamente eficaz frente a Mycobacterium leprae[14].
RESISTENCIA BACTERIANA AL ÁCIDO FUSÍDICO
Se han identificado varias mutaciones que dan lugar al desarrollo de resistencia bacteriana al ácido fusídico en las cepas susceptibles.
- Mutación del gen “fusA”: disminuye la afinidad del ácido fusídico por el Factor de Elongación ribosómico. Esta mutación se ha notificado en Staphylococcus aureus, Streptococcus epidermidis y diversas especies del género Salmonella (Salmonella typhi, Salmonella paratyphi).
- Mutación del gen “fusB”: es la causa más frecuente de pérdida de susceptibilidad. Este gen mutante forma parte de un plásmido de 21kd[15]. Este gen codifica una proteína que, de alguna manera, protege al Factor de Elongación frente al ácido fusídico. Este plásmido (elementos génico móvil) es prevalente en casos de impétigo causado por Staphylococcus aureus resistente al ácido fusídido.
- Mutaciones “fusC” y “fusD” son homólogas de la mutación “fusB” pero localizadas en el cromosoma de Staphylococcus aureus y Staphylococcus saprophyticus.
- Mutación “fusE”, observada en cepas de Staphylococcus aureus fusídico-resistente que se traduce en la aparición de colonias fenotípicamente distintas[16].
- Síntesis de una acetiltransferasa (observado en enterobacteriáceas).
- Desacetilación del ácido fusídico por una enzima con actividad esterasa (observado en cepas de Streptomyces).
- Eflujo del ácido fusídico al exterior de la bacteria por un sistema de bombeo AcrAB-TolC (observado en cepas de Escherichia coli).
Durante los últimos años un clon causante de impétigo bulboso (portador de la mutación “fusB”) se ha expandido ampliamente por el norte de Europa[17]. Por esta, y otras razones, el ácido fusídico se debería reservar para infecciones por Staphylococcus meticilin-resistentes. Cuando se utiliza por vía sistémica debería asociarse con otros antibióticos (penicilinas isoxazólicas, vancomicina o rifampicina).
FARMACOCINÉTICA DEL ÁCIDO FUSÍDICO
Siguiendo la administración oral, la biodisponibilidad del ácido fusídico es del 69%, pero con una enorme variabilidad. Al cabo de 1 hora de la toma de un comprimido de 250mg de ácido fusídico la concentración plasmática puede variar desde 0,7mcg/ml a 35mcg/ml; al cabo de 2 horas tras la administración el rango de concentraciones plasmáticas se estrecha (14mcg/ml – 38mcg/ml).
En estudios in vitro, la unión a proteínas es muy elevado (>97%).
Tras una dosis de 500mg per os, CMÁX es de 27mcg/ml (valor promedio). Tras este máximo, la concentración disminuye, siendo todavía detectable al cabo de 24 horas tras la administración. La vida plasmática media (T1/2) se halla en el rango de 10 a 16 horas.
El ácido fusídico se distribuye muy bien por todos tejidos del organismo. Atraviesa la barrera placentaria.
El ácido fusídico apenas difunde al tejido nervioso de personas con las meninges normales. Sin embargo, sí atraviesa las meninges cuando éstas están inflamadas, lográndose concentraciones cercanas a las CIM para los staphylococi coagulasa-negativos.
El antibiótico ácido fusídico difunde de modo suficiente en articulaciones inflamadas durante procesos reumáticos.
CONSECUENCIAS CLÍNICAS DE LA FARMACOCINÉTICA DEL ÁCIDO FUSÍDICO
No hay consenso en relación a la actividad bacteriostática o bactericida del ácido fusídico, dependiendo de diversos factores tales como la concentración del antibiótico en el lugar de la infección, el tamaño del inóculo, y la susceptibilidad particular de las distintas cepas de Staphylococcus aureus. Estas circunstancias determinan que la consideración del antibiótico como bacteriostático o bactericida sea relativa.
El «efecto post-antibiótico» del ácido fusídico es modesto con una duración máxima de 2 o 3 horas (estudios en Staphylococcus aureus y Streptococcus epidermidis).
Gran parte del ácido fusídico sistémico se metaboliza en el hígado, convirtiéndose en metabolitos con algo de actividad antibiótica residual.
La cantidad de antibiótico (y sus metabolitos) recogidos en orina, heces y bilis es inferior a la dosis total administrada. De hecho, la cantidad de ácido fusídico excretada por los riñones es < 1% de la dosis administrada. A pesar de las baja concentración del antibiótico detectada en la bilis, ésta es suficiente para el tratamiento de la diarrea por Clostridium difficile.
INTERACCIONES FARMACOLÓGICAS
Como cualquier fármaco con una elevada tasa de unión a proteínas plasmáticas y metabolismo hepático, cabe prever un significativo número de interacciones farmacológicas.
Un ejemplo son los cuadros de rabdomiolisis[18] en pacientes tratados con simvastatina que reciben tratamiento sistémico (oral o intravenoso) con ácido fusídico.
[1] Todas las cefalosporinas antibióticas derivan de la cefalosporina C.
[2] Emulsiones semisólidas O/W (Oil/Water), o W/O (Water/Oil)
[3] Emulsiones semilíquidas O/W (Oil/Water), o W/O (Water/Oil); a veces se refieren como ungüentos.
[4] Harvey C.L., Knights S.G., Sih C.J. On the mode of action of fusidic acid. Biochemistry 1966; 5: 3320.
[5] La existencia de pared celular diferencia a las bacterias en Gram positivas y Gram negativas, en función de la fijación del colorante desarrollado por Hans Christian Joachim Gram.
[6] kd: kilo daltons [dalton es equivalente a unidad de masa atómica, siendo la forma de expresar el peso molecular de las moléculas de gran tamaño, tal como proteínas o ácidos nucleicos].
[7] El gen Ras es apócope de Rats sarcome, porque fue identificado en ratas afectadas de sarcoma.
[8] Fucidine H® pomada.
[9] t.i.d.: ter in die (tres veces al día)
[10] Glucuronidación: conjugación con ácido glucurónico.
[11] Peter J-D, Jehl F., Pottecher T., et al. Pharmacokinetics of Intravenous fusidic acid in patients with cholestasis. Antimicrob Agents Chemother 1993; 37: 501.
[12] Howden B., Grayson ML. Dumb and dumber – the potential waste of a useful antistaphylococcal agent: emerging fusidic acid resistance in Staphylococcus aureus. Clin Infect Dis 2006; 42: 394-400.
[13] La CIM de las cepas de Clostridium difficile susceptibles al ácido fusídico varía de 0,5mcg/ml a 64mcg/ml.
[14] Franzblau S.G., Biswas A.N., Harris E.B. Fusidic acid is highly active against extracellular and intracellular. Mycobacterium leprae. Antimicrob Agents Chemother 1992; 36: 92.
[15] Kd: kilodalton [Dalton: unidad de masa atómica].
[16] Afectan a la proteína ribosómica L6.
[17] Tveten Y., Jenkins A., Kristiansen B-E. A fusidic acid resistant clone of Staphylococcus aureus associated with impetigo bullosa is spreading in Norway. J Antimicrob Chemother 2002; 50: 873-6.
[18] Rabdomiólisis: destrucción del músculo esquelético que libera a la sangre diversos compuestos nefrotóxicos.
Zaragoza, julio 2016
FARMACIA LAS FUENTES
ZARAGOZA