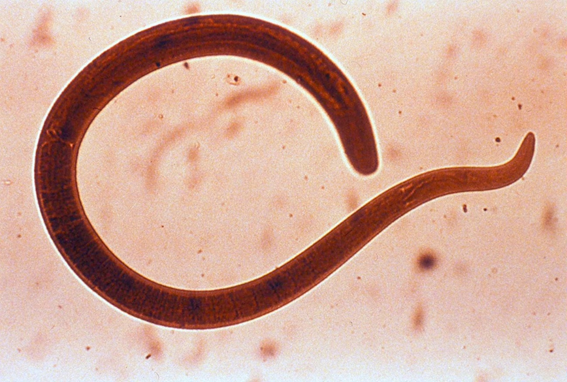
ASCARIDIASIS. ASPECTOS HISTÓRICOS
Ascaris lumbricoides, prototipo de los denominados «gusanos redondos» que infectan al hombre, es uno de los seis que describió Linneo. Se estima que no menos de mil millones de personas (sobre todo niños) están infectadas, con una mortalidad anual de alrededor de 20.000 infectados (generalmente por varios parásitos simultáneamente).
El sintagma «gusano redondo» incluye no solo a los nematodos sensu stricto, sino a las denominadas «serpientes cabello» (por su grosor). Los acantocéfalos, que durante mucho tiempo se consideraron intermedios entre los nematodos («gusanos redondos») y nematomorfos («serpientes cabello»), se incluyen ahora en el phylum nematelmintos. Las «serpientes cabello» (gordiáceos) no son parásitos humanos.
Al phylum Nematoda pertenecen Ascaris lumbricoides, Trichinella spiralis y las filarias Wucherechia brancofti[1] («filaria de Bancroft») y Onchocerca volvulus. Las filarias parásitas humanas requieren un díptero hematófago como hospedador intermediario, mientras el ciclo biológico de Ascaris lumbricoides se constituye en dos etapas: estadio parásito [en el hombre] y fase de vida libre [en el suelo].
Las lesiones que pueden desencadenar los gusanos mencionados no están directamente relacionadas con el número de parásitos presentes. Así, por ejemplo, un par de diminutas «filarias de Bancroft» causan lesiones tisulares mucho más graves que cientos de Ascaris lumbricoides.
 Los gusanos adultos de Ascaris lumbricoides se alojan en el intestino humano; las hembras, ovíparas, ponen multitud de huevos que se expulsan junto con las heces. Las larvas comienzan su desarrollo en el interior del huevo, y lo continúan una vez eclosionan en el suelo. La infección humana se produce por la ingestión de alimentos contaminados por huevos o larvas. Una vez ingeridas, las larvas perforan la mucosa intestinal, migrando a través del organismo hasta alcanzar los pulmones, primero el parénquima pulmonar, después los alveolos y los bronquiolos y bronquios. Desde allí son expulsadas al toser o deglutidas al intestino donde maduran hasta gusanos adultos. La migración de las larvas a través del organismo y la consiguiente reacción inmune y de hipersensibilidad son causa de la sintomatología asociada a la infección. Cuando la carga de gusanos es elevada se puede producir obstrucción intestinal.
Los gusanos adultos de Ascaris lumbricoides se alojan en el intestino humano; las hembras, ovíparas, ponen multitud de huevos que se expulsan junto con las heces. Las larvas comienzan su desarrollo en el interior del huevo, y lo continúan una vez eclosionan en el suelo. La infección humana se produce por la ingestión de alimentos contaminados por huevos o larvas. Una vez ingeridas, las larvas perforan la mucosa intestinal, migrando a través del organismo hasta alcanzar los pulmones, primero el parénquima pulmonar, después los alveolos y los bronquiolos y bronquios. Desde allí son expulsadas al toser o deglutidas al intestino donde maduran hasta gusanos adultos. La migración de las larvas a través del organismo y la consiguiente reacción inmune y de hipersensibilidad son causa de la sintomatología asociada a la infección. Cuando la carga de gusanos es elevada se puede producir obstrucción intestinal.
La ascaridiasis es una infección ubicua, habiéndose hallado coprolitos en lugares tan diversos como momias egipcias, restos de la dinastía Ming (China) y restos arqueológicos de Sudamérica.
Los gusanos adultos se visualizan en las heces o sobresaliendo del año, debido a su considerable tamaño, de entre 15 y 35cm.
A pesar de haber sido descrito en papiros egipcios y en textos romanos y árabes, el primer estudio anatómico detallado se debe al médico británico del siglo XVII Edward Tyson (1683) y al italiano Francisco Redi (1684). Estas dos publicaciones, junto con otra ulterior de Edward Tyson sobre los platelmintos fueron la piedra angular del surgimiento de la helmintología, una rama de la parasitología que alcanzó su época álgida durante el siglo XIX. [Edward Tyson también llevó a cabo la distinción entre monos antropoides y el resto de los simios].
En el año 1849 Swayne describió los huevos de los áscaris, si bien creyó que eran responsables del cólera.
Pocos años después, en 1856, Ransom comenzó a diagnosticar ascaridiasis por la presencia de huevos en heces.
Gros, trabajando en Moscú, incubó huevos de Ascaris lumbricoides. Observó que aunque la división se iniciaba al cabo de 24 horas, la maduración completa de las larvas tardaba alrededor de cuatro meses.
Al principio se desconocía cómo se producía el contagio. En 1862 los trabajos del médico francés Casimir Joseph Davaine y del italiano Giovanni Batista Grassi (quien ingirió más de 100 huevos examinando sus heces hasta que halló huevos al cabo de 22 días) permitieron pergeñar su ciclo biológico completo
Stewart, en Hong-Kong, en el año 1915, experimentó con cerdos y ratas, descubriendo que, tras la ingestión de huevos fecundados de Ascaris lumbricoides, los pulmones de los animales se congestionaban con numerosas larvas activas. Tras la ingestión de los huevos, las larvas eclosionaban en el intestino; unas pocas eran expulsadas junto con las heces, pero la mayoría perforaban la pared intestinal. Al cabo de pocos días las larvas estaban presentes en los vasos sanguíneos de los pulmones, así como en el hígado. Al sexto día las larvas se localizaban en los alveolos pulmonares y en los bronquios y bronquiolos. Stewart creyó que la rata era un hospedador intermediario, y la infección se adquiría consumiendo alimentos contaminados con la saliva del roedor.
Shimesu Koino desenredó el error, aclarando el mecanismo de contagio, confirmando que la perpetuación de la infección no precisaba de otro hospedador distinto del hombre. Para demostrarlo, Koino ingirió alrededor de dos mil huevos fecundados; al tercer día halló huevos en su esputo; y el undécimo día desarrolló un cuadro febril, con cefalea y dificultad respiratoria (disnea). Cincuenta días más tarde se trató con un fármaco antihelmíntico de amplio espectro liberando aproximadamente 667 gusanos en sus heces. De este modo demostró que la transmisión de Ascaris lumbricoides es directa.
Una infección exclusiva por áscaris es infrecuente, ya que los pacientes suelen estarlo por otros gusanos. El principal problema asociado con la infección es la reacción de hipersensibilidad del organismo durante la migración de las larvas desde el intestino al pulmón, así como el riesgo de obstrucción intestinal cuando hay un elevado número de gusanos adultos en el intestino.
Los tratamientos aplicados han sido variados: purgantes que estimulen el peristaltismo y contribuyan a la expulsión de los parásitos (aceite de castor, extractos de senna (planta de la familia de las fabáceas), camomila, trementina, quenopodio, etc.), otros son la corteza del árbol de la granada, el alga roja (Digenea simplex), timol, santonina, etc.
Estos remedios populares dejaron paso a otros más químicos, tales como: hexilresorcinol, betanaftol y tetracloruro de carbono. A éstos le siguió la piperacina, menos tóxica, y que ya se utilizaba también para el tratamiento de la gota. Se desarrollaron diversos derivados de la piperacina (citrato, adipato, fosfato), todos ellos de baja toxicidad y coste reducido. No obstante, el tratamiento actual se fundamenta en tres medicamentos: Levamisol, Mebendazol y Pirantel, menos tóxicos y más eficaces que la piperacina y derivados.
LEVAMISOL.-
 Un programa de investigación de compuestos anti-helmínticos desarrollado por Janssen Research Laboratories, en su sede primigenia de Beerse, Bélgica, condujo a la síntesis del aminotiazol R6438. El compuesto se mostró eficaz frente a las parasitosis por helmintos en ovejas y pollos, pero no en ratones y ratas, hecho que se atribuyó a que la molécula [R6438] era, de hecho, un pro-fármaco que precisaba su metabolización a un derivado farmacológicamente activo, y no todos los animales tenían las enzimas hepáticas para catalizar dicha reacción química. Se sintetizaron y estudiaron todos los metabolitos de R6438; solo el designado R8141 mostró acción farmacológica. Sin embargo, su síntesis era compleja y la formulación hidrosoluble era muy inestable. Una búsqueda de análogos estructurales condujo al tetramisol, si bien solo su isómero levorrotatorio (Levamisol) tenía efecto anti-helmíntico.
Un programa de investigación de compuestos anti-helmínticos desarrollado por Janssen Research Laboratories, en su sede primigenia de Beerse, Bélgica, condujo a la síntesis del aminotiazol R6438. El compuesto se mostró eficaz frente a las parasitosis por helmintos en ovejas y pollos, pero no en ratones y ratas, hecho que se atribuyó a que la molécula [R6438] era, de hecho, un pro-fármaco que precisaba su metabolización a un derivado farmacológicamente activo, y no todos los animales tenían las enzimas hepáticas para catalizar dicha reacción química. Se sintetizaron y estudiaron todos los metabolitos de R6438; solo el designado R8141 mostró acción farmacológica. Sin embargo, su síntesis era compleja y la formulación hidrosoluble era muy inestable. Una búsqueda de análogos estructurales condujo al tetramisol, si bien solo su isómero levorrotatorio (Levamisol) tenía efecto anti-helmíntico.
Bibliografía recomendada del Levamisol:
- Raeymaekers A.H.M., et al. Novel broad-spectrum antihelmitics. Tetramisol and related derivatives of 6-aryimidazol [2, 1-b] thiazole. Med. Chem. 1966; 9: 545-51.
- Bullock M.W., et al. Resolution and racemitation of d,l-tetramisole-d,l-6-phenyl-2,3,5,6-tetrahydroimidazo [2,1-b] thiazole. J. Med. Chem. 1968; 11: 169-71.
- Janssen P.A.J. The levamisol story. Drug Res. 1976; 20: 347-83.
MEBENDAZOL.-
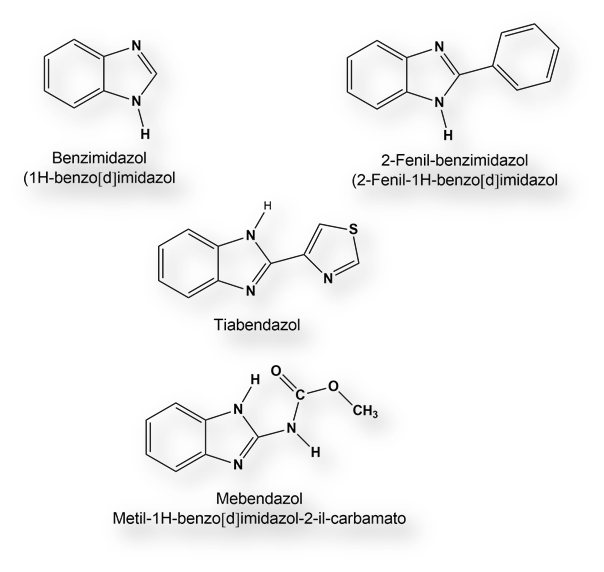 Hacia el año 1953 se descubrió la potencial eficacia anti-helmíntica de los derivados del bencimidazol. De entre todos los derivados químicos de la estructura benzoimidazólica el derivado 2-fenilo del bencimidazol evidenció la suficiente eficacia para su estudio detallado. Siguiendo esta línea de investigación se sintetizó el Tiabendazol: 1 parte en un millón prevenía el desarrollo in vitro de Ascaris lumbricoides. Enseguida se convirtió en el tratamiento electivo de las infecciones por Strongyloides stercolaris, muy común en regiones tropicales.
Hacia el año 1953 se descubrió la potencial eficacia anti-helmíntica de los derivados del bencimidazol. De entre todos los derivados químicos de la estructura benzoimidazólica el derivado 2-fenilo del bencimidazol evidenció la suficiente eficacia para su estudio detallado. Siguiendo esta línea de investigación se sintetizó el Tiabendazol: 1 parte en un millón prevenía el desarrollo in vitro de Ascaris lumbricoides. Enseguida se convirtió en el tratamiento electivo de las infecciones por Strongyloides stercolaris, muy común en regiones tropicales.
El siguiente objetivo era hallar un sosia farmacológico más resistente a la inactivación enzimática y, consecuentemente, con una mayor difusión tisular. Los investigadores de Janssen Pharmaceuticals lograron la síntesis del Mebendazol, un anti-helmíntico de amplio espectro, eficaz frente a una variedad de helmintiasis.
Bibliografía recomendada sobre Mebendazol.-
- Brown H.D., et al. Antiparasitic drugs IV. 2-(4’-thiazolil)-benzimidazole, a new antihelmintic. Am. Chem. Soc. 1961; 83: 1764-5.
- Brugans J.P., et al. Mebendazole in enterobiasis. Radiochemical and pilot clinical study in 1,278 subjects. Am. Med. Assoc. 1971; 217: 313-16.
PIRANTEL.-
 Durante la década de 1950, el laboratorio estadounidense Pfizer desarrolló un programa de investigación de potenciales medicamentos anti-helmínticos.
Durante la década de 1950, el laboratorio estadounidense Pfizer desarrolló un programa de investigación de potenciales medicamentos anti-helmínticos.
Los compuestos se ensayaban ratones infectados con tres gusanos: Hymenolepsis nana (platelminto), Nematospiroides dubius (nematodo) y Syphacia obvelata (lombriz intestinal).
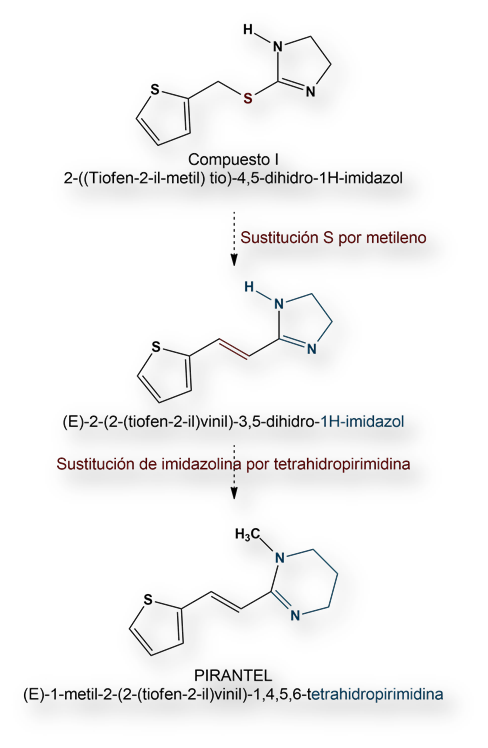
De todas las múltiples moléculas, solo una (designada: compuesto I) mostró algo de actividad. Cuando se administraba oralmente a ovejas, su actividad era escasa, probablemente porque se hidrolizaba hasta compuestos que habían servido de punto de partida para su síntesis.
Los trabajos se dirigieron a la síntesis de una molécula que resistiese la hidrólisis tras su administración oral. En primer lugar, el átomo de S del compuesto I se reemplazó por un grupo metileno. Una ulterior optimización consistió en sustituir la estructura imidazolina por otro anillo tetrahidropirimidina. El resultado de ambas modificaciones fue el fármaco Pirantiel. Es activo por vía oral, con amplio espectro de acción anti-helmíntica.
Bibliografía recomendada:
- Lynch J.E., Nelson B. Preliminary antihelmintic studies with Nematospiroides dubius in mice. J. Parasitol. 1959; 45: 659-62-
- McFarland J.W., et al. Novel antihelmintic agents. Pyrantel and other cyclic amidines. J. Med. Chem. 1969; 12: 1066-79.
Durante la década de 1950 se usaba en la URSS una atrabiliaria técnica consistente en pasar mediante un tubo 1 o 2 litros de oxígeno por el intestino (Ascaris lumbricoides es anaerobio), administrando al cabo de dos hora una dosis de sulfato magnésico como laxante.
La ascaridiasis es muy difícil de erradicar en áreas endémicas debido a las deficientes infraestructuras para el tratamiento de aguas residuales, y la costumbre de usar excrementos como fertilizantes con la consiguiente elevada carga parasitaria de los suelos.
En las regiones con mayor prevalencia de la infección se han intentado campañas de tratamiento masivo de la población con antihelmínticos, pero los costes han sido un factor limitante.
Dos trabajos exhaustivos sobre Ascaris lumbricoide son los publicados por Grove[2] y Goodwin[3].
Zaragoza, a 3 de septiembre de 2020
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Farmacia Las Fuentes
Florentino Ballesteros, 11-13
50002 Zaragoza
[1] Patronímicos de Otto Wucherer y Joseph Bancroft.
[2] Grove D.L. A History of Heminthology 1990.
[3] Godwinn L. Ascariasis. The Wellcome Trust Illustrated of Tropical Diseases. The Wellcome Trust.