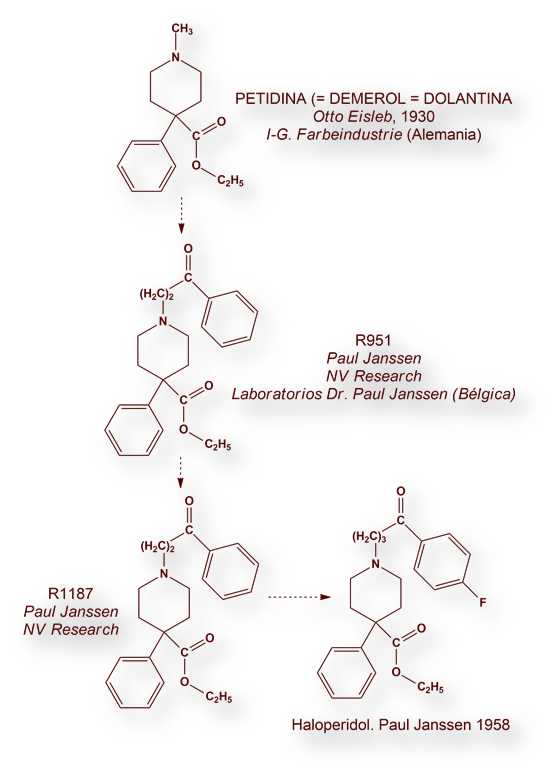
El grupo dirigido por Paul Janssen (fotografía no datada) modificó la estructura química de la Petidina (=Dolantina = Demerol), un opiáceo de síntesis, añadiendo diferentes radicales al átomo de nitrógeno, en sustitución del grupo metilo, hasta obtener un compuesto (R951).
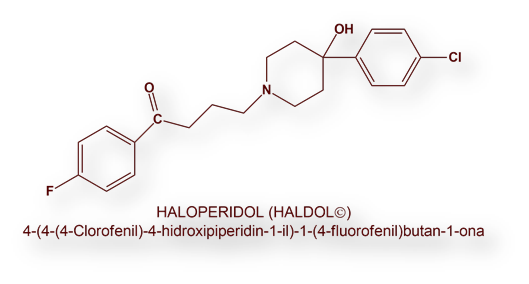 Partiendo del R951 sintetizó en 1957 la primera butirofenona, a la designó R1187. Esta molécula mostró efectos sedante y analgésico. La siguiente etapa del proyecto consistió en modificar la estructura química de R1187 para anular su efecto analgésico. Pocos meses después, el 11 de febrero de 1958, la cuadragésimo quinta butirofenona, fue sintetizada por Bert Herman, investigador del grupo de Janssen, a la que se designó con el número de catálogo R1625 patentada poco después con el nombre de Haloperidol.
Partiendo del R951 sintetizó en 1957 la primera butirofenona, a la designó R1187. Esta molécula mostró efectos sedante y analgésico. La siguiente etapa del proyecto consistió en modificar la estructura química de R1187 para anular su efecto analgésico. Pocos meses después, el 11 de febrero de 1958, la cuadragésimo quinta butirofenona, fue sintetizada por Bert Herman, investigador del grupo de Janssen, a la que se designó con el número de catálogo R1625 patentada poco después con el nombre de Haloperidol.
Apenas ¡dos días! después de su síntesis se inició la experimentación en animales. En aquellos años, los trámites burocráticos no enlentecían los procedimientos como en la actualidad; y el 17 de marzo (1958), todavía inconclusos los estudios en animales, Paul Janssen entregó pequeñas cantidades de la nueva sustancia a un psiquiatra de Bruselas (Bloch) para que la ensayara en pacientes. Éste inyectó 2mg de Haloperidol por vía intravenosa a unos pocos pacientes con delirium tremens[1]. Al mismo tiempo, Janssen hizo llegar muestras de Haloperidol a tres psiquiatras de Lieja (Divry, Bobon y Colard) para que lo probasen en pacientes verdaderamente psiquiátricos, no solo en alcohólicos como hizo el psiquiatra bruselense.
Durante el otoño [1958] los resultados de un ensayo con 18 pacientes que en conjunto recibieron más de 100 administraciones de dosis de entre 2 y 5mg, se presentaron en la Sociedad Belga de Enfermedades Mentales. Todos los pacientes sufrían de gran agitación psicomotriz [2] achacable a psicosis o neurosis. En todos los enfermos se observaba un notable efecto sedante transcurridos 5 a 15 minutos de la inyección intravenosa, persistiendo su acción sedante durante 3 a 5 horas. Todos los psiquiatras declararon que la sustancia [Haloperidol] mostraba una tolerancia excelente. Haloperidol, se decía, potenciaba el efecto hipnótico de los barbitúricos. Fue así como el Haloperidol se convirtió en el tratamiento de elección en los cuadros de agitación psicomotora, con independencia de su etiología[3]. El Haloperidol mostró una potencia entre 50 y 100 veces superior a la de la Clorpromacina, y daba lugar a menos efectos adversos de tipo extra-piramidal[4].
Los estudios anteriores hoy día no se considerarían válidos para la autorización de un nuevo medicamento; sí lo fueron entonces, gracias a lo cual disponemos hoy día de un excelente medicamento, tan valioso a finales de 1950 como en la actualidad.
A partir de 1959, se produjo un incremento exponencial de los ensayos clínicos [del Haloperidol] en Europa Occidental. Así, el 5 de septiembre de 1959, 45 psiquiatras, psicólogos, neurólogos, anestesistas y farmacólogos de 11 países europeos asistieron al Primer Congreso Internacional dedicado específicamente al Haloperidol. Mucha de la información reflejada en aquel simposio no ha sido superada en la actualidad: … su utilidad [del Haloperidol] en el tratamiento de la agitación psicomotora, alucinaciones, síntomas maníacos (en enfermos con patología maníaco-depresiva[5]), ideación paranoide, movimientos coreicos, tics, tendencias agresivas, así como ciertas formas de ansiedad, insomnio, náusea y vómito, y, en general, todas las indicaciones para las que continúan siendo útiles los fármacos neurolépticos. Se detallaron también los efectos adversos en el rango de dosis usadas de sólito (1-5mg, per os o parenteralmente).
Paul Janssen, nació en Bélgica en 1921, falleciendo en Roma en 2003. La empresa farmacéutica homónima (Janssen Pharmaceuticals) creada por él a los 27 años de edad asumiendo elevados riesgos financieros se fusionó con Johnson & Johnson en febrero de 1961.
Janssen Pharmaceuticals fue el primer laboratorio occidental que se asentó en la República Popular China. Contribuyó de manera trascendente a la recuperación del tesoro de los soldados de terracota, muy desfigurados por el moho. Janssen aplicó un producto anti-fúngico que consiguió devolverles todo esplendor.
El Haloperidol fue el fármaco neuroléptico más vendido de la Historia. Miles de moléculas con estructura química de butirofenona se han sintetizado desde entonces, pero ninguna ha mejorado la farmacología del Haloperidol. A pesar de todo se patentaron alrededor de 100 nuevas butirofenonas; y durante la década de 1970 no menos de 25 moléculas estructuralmente análogas al Haloperidol estaban siendo estudiadas en ensayos clínicos para uso humano y veterinario. De todas ellas, solo dos han pervivido: Droperidol, usando principalmente en anestesiología[6]; y Azapirona, empleada exclusivamente en medicina veterinaria.
En el año 1963 Paul Janssen sintetizó tres moléculas con estructura difenilbutilpiperidina: Pimozida, Fluspirileno y Penfluridol. La farmacología de estas moléculas difería de los neurolépticos clásicos. Su duración de acción era prolongada, planteándose como alternativa a los neurolépticos en formulación depot de estructura derivada de la fenotiacina.
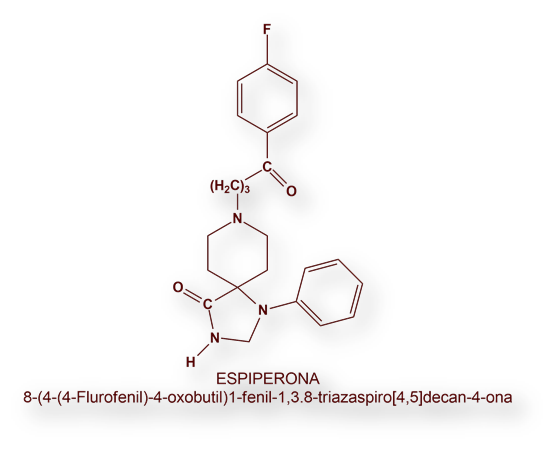 Otra butirofenona, Espiperona, ha hallado utilidad, una vez marcada radiactivamente[7], para radiografiar la distribución de los receptores cerebrales serotoninérgicos.
Otra butirofenona, Espiperona, ha hallado utilidad, una vez marcada radiactivamente[7], para radiografiar la distribución de los receptores cerebrales serotoninérgicos.
Todos los fármacos referidos en este escrito son antagonistas de la actividad dopaminérgica, acción que logran mediante el bloqueo de los receptores para el neurotransmisor dopamina. Así pues, bloquean las acciones de la dopamina endógena, así como la causada por fármacos dopaminérgicos.
Los efectos se consiguen de modo diferido, tras un período de latencia de varias semanas.
Su principal efecto terapéutico es el control de los síntomas positivos de los cuadros clínicos psicóticos, bien endógenos, subsidiarios de demencia senil o tras la cirugía cardíaca post-infarto agudo de miocardio. No obstante, tienen otros usos clínicos, todos ellos a través de su antagonismo dopaminérgico. Se usan como antieméticos, en el tratamiento del Síndrome de Tourette, el hipo y/o el prurito incontrolable.
Se encuadran bajo la catalogación de neurolépticos. El bloqueo del receptor para la dopamina puede desencadenar el Síndrome Neuroléptico Maligno[8].
Zaragoza, 17 de junio de 2020
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Zaragoza
[1] Delirium tremens (“delirio tembloroso”) es consecuencia de la abstinencia en alcohólicos crónicos.
[2] Divry P., Bobon J., Collard J. R1625 ‒ New symptomatic treatment of psychomotor agitation. Acta Neurol. Psychiatr. Belg. 1958; 10: 878-888.
[3] Janssen P.A.J.: The Butyrophenone Story. In: Ayd FJ Jr. Blackwell B. (eds): Discoveries in Biological Psychiatry. Baltimore Ayd Medical Communications 1984: 165-179.
[4] Efectos extra-piramidales: discinesias agudas o retardadas, reacciones distónicas, acinesia, acatisia y Síndrome Neuroléptico Maligno. Los efectos extra-piramidales se deben al bloqueo dopaminérgico y/o depleción del neurotransmisor dopamina de los ganglios basales. A menudo la falta de dopamina mimetiza ciertas patologías idiopáticas, tales como la enfermedad de Parkinson. Aun cuando los efectos extra-piramidales son yatrogenia de los medicamentos antipsicóticos, otros fármacos también pueden desencadenarlos, tales como antidepresivos, antiepilépticos, sales de litio, antieméticos y, muy raramente, anticonceptivos.
[5] Hoy día referida como enfermedad bipolar
[6] La indicación aprobada en España para el Droperidol (Xomolix® ampollas de 1ml conteniendo 2,5mg) es como antiemético post-quirúrgico o para el control de la emesis durante los tratamientos con opiáceos en la analgesia controlada por el paciente.
[7] Sustituyendo un átomo por su isótopo radiactivo, de tal suerte que la radiación emitida durante su desintegración permite su trazabilidad.
[8] Síndrome Neuroléptico Maligno: es una yatrogenia derivada del tratamiento con neurolépticos u otros medicamentos antipsicóticos. Se le incluye entre los síntomas extra-piramidales. El pródromo incluye: fiebre elevada, sudoración, presión arterial irregular, estupor, rigidez muscular y disfunción del Sistema Nervioso Autónomo. En algunos casos el Síndrome Neuroléptico Maligno debuta a las dos semanas de iniciar el tratamiento (antes de que los efectos terapéuticos sean perceptibles). En cualquier caso puede manifestarse durante el tratamiento. Este cuadro clínico también puede surgir durante los tratamientos anti-parkinsonianos (dopaminérgicos) si se interrumpen bruscamente.