ASPECTOS FISIOLÓGICOS BÁSICOS
La glándula tiroides está formada por dos lóbulos separados por un istmo. Se sitúa en el cuello, muy cerca de la superficie, contigua a la laringe, faringe y tráquea. En un adulto normal (eutiroideo) tiene un tamaño (longitud de los lóbulos) de entre 50 y 60mm, y un peso de entre 16 gramos, algo mayor en las mujeres (hasta 1 gramos). Etimológicamente el término tiroides deriva del griego, y su transliteración al latín, que significa escudo, en virtud de su aspecto.
Regulación de la función tiroidea.-
Glosario de acrónimos:
TRH: Tyrotropin Releasing Hormone (péptido hipotalámico, inductor de la secreción de TSH por la hipófisis).
TSH: Tyroxin Stimulating Hormone (péptido hipofisario, inductor de la secreción de hormona tiroidea). También se denomina tirotropina.
Hipófisis y glándula pituitaria, son sinónimos
Hormona tiroidea o tiroxina: engloba a los péptidos T4 (tretrayodotironina) y T3 (triyodotironina) De hecho, gran parte de la actividad tiroidea se debe a la T3.
Tiroglobulina: proteína globular que transporta en sangre a T4 y T3.
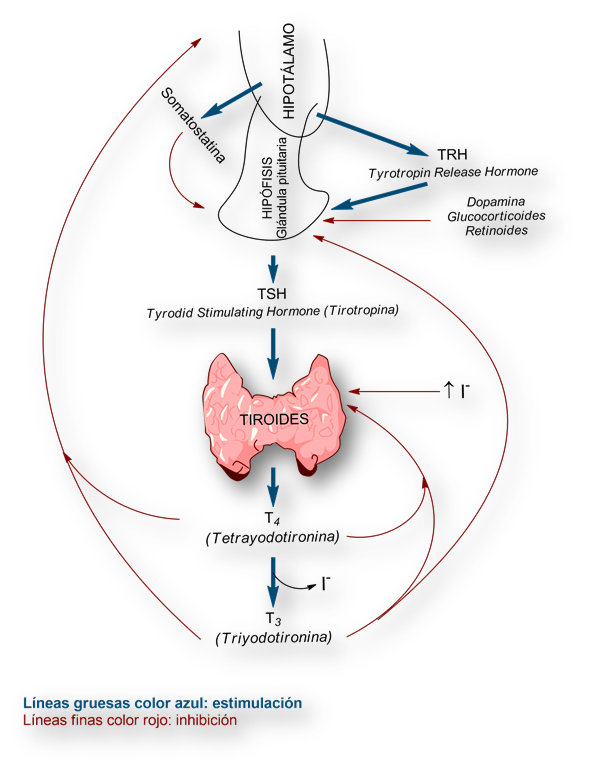 La tirotropina o TSH (Tyroxin Stimulating Hormone) es una glucoproteína, con una estructura secundaria (subunidades hélice α y hoja plegada β) que remedan la de las gonadotropinas.
La tirotropina o TSH (Tyroxin Stimulating Hormone) es una glucoproteína, con una estructura secundaria (subunidades hélice α y hoja plegada β) que remedan la de las gonadotropinas.
La TSH se segrega por la hipófisis (glándula pituitaria) de una manera pulsátil ajustado a un ritmo circadiano, de tal suerte que los máximos de secreción se producen durante el sueño nocturno. El estímulo para su secreción por la hipófisis procede de un péptido segregado por el hipotálamo, designado TRH.
TRH (Tyrotropin Releasing Hormone).-
TRH es un tripéptido segregado a la circulación hipotalámica portal. Su secreción depende de los niveles de T4 (tetrayodotironina) y T3 (triyodotironina) en plasma según un mecanismo de retroalimentación negativo (feedback).
El péptido TRH hipotalámico estimula la secreción de la TSH hipofisaria, almacenada en gránulos en los tirocitos (células de la glándula tiroides).
[La TRH es también un neurotransmisor o neuromodulador extrahipofisario. Este péptido se ha identificado en diversos lugares del organismo (islotes pancreáticos, testículos, corazón y tracto gastrointestinal, sin que se conozca que función desempeña en estos órganos. Se están investigando posibles sosias de TRH para potenciales aplicaciones terapéuticas distintas de su función hormonal].
TSH (Tyrosin Stimulating Hormone, también denominada tirotropina).-
Cuando se inyecta TSH en un animal de experimentación, al cabo de pocos minutos se observa un incremento significativo de la secreción de hormona tiroidea (Tiroxina).
Recordemos que bajo el epíteto de Tiroxina u «hormona tiroidea» se engloban tanto la T4 (tetrayodotironina) como la T3 (triyodotironina), si bien la actividad hormonal depende fundamentalmente de esta última, T3.
Yodo y glándula tiroides.-
El yodo también estimula la función tiroidea: de la vascularización de la glándula, de la síntesis, endocitosis (pinocitosis), proteólisis del coloide e hiperplasia de la glándula.
 Para una correcta función de la glándula tiroides es imprescindible una ingesta de yodo suficiente. En su ausencia, la TSH hipofisaria trata compensar la situación segregándose en mayor cantidad. Con ello no se soluciona el problema. Antes al contrario, la glándula tiroides aumenta de tamaño (hiperplasia e hipertrofia). Una glándula tiroides hipertrofiada consigue extraer el yodo de la sangre de manera muy eficiente. Si la deficiencia de ingesta de yodo es moderada, la glándula tiroides hipertrofiada segrega sobre todo T3 (no T4) y, muchas veces, operando en condiciones límite consigue mantener una actividad fisiológica adecuada. Si la deficiencia de yodo es extrema, este mecanismo compensatorio se ve sobrepasado, desarrollándose hipotiroidismo y cretinismo.
Para una correcta función de la glándula tiroides es imprescindible una ingesta de yodo suficiente. En su ausencia, la TSH hipofisaria trata compensar la situación segregándose en mayor cantidad. Con ello no se soluciona el problema. Antes al contrario, la glándula tiroides aumenta de tamaño (hiperplasia e hipertrofia). Una glándula tiroides hipertrofiada consigue extraer el yodo de la sangre de manera muy eficiente. Si la deficiencia de ingesta de yodo es moderada, la glándula tiroides hipertrofiada segrega sobre todo T3 (no T4) y, muchas veces, operando en condiciones límite consigue mantener una actividad fisiológica adecuada. Si la deficiencia de yodo es extrema, este mecanismo compensatorio se ve sobrepasado, desarrollándose hipotiroidismo y cretinismo.
La deficiencia de yodo continúa siendo prevalente en muchas regiones del mundo: Centroamérica y Sudamérica, África, regiones poco desarrolladas de Europa oriental y China. [Referencia bibliográfica: Zimmerman MB. Iodine deficiency. Endocr Rev, 2009; 30: 376-408].
El alimento con mayor contenido de yodo es el pescado. Los vegetales y las carnes (rojas o blancas) lo contienen en mínimas cantidades. Las dosis diarias de yodo recomendadas son las siguientes: niños (90-120mcg; adultos (150mcg; embarazadas (200mcg); madres lactantes (290mcg). [1mcg equivales a 0,001mg].
Las sales de yodo se han utilizado de manera empírica durante más de 150 años para tratar el bocio (una hipertrofia manifiesta de la glándula tiroides). En la actualidad se ha instaurado el uso de sal yodada, sobre todo en regiones en las que el contenido de yodo del agua de consumo es exiguo.
En países desarrollados el único grupo de población susceptible de ingerir insuficientes cantidades de yodo son las embarazadas y las madres lactantes, dado que sus requerimientos son mayores (ver párrafos previos).
El cretinismo es una deficiencia congénita de la síntesis de hormona tiroidea, aun cuando los niveles plasmáticos de TSH son elevados. Es una forma extrema de hipotiroidismo congénito.
MEDICAMENTOS COMERCIALIZADOS EN ESPAÑA
Tratamiento sustitutivo de la hormona tiroidea:
 Levotiroxina (Eutirox®) comprimidos en un amplio rango de dosificaciones, desde 25mcg a 200mcg.
Levotiroxina (Eutirox®) comprimidos en un amplio rango de dosificaciones, desde 25mcg a 200mcg.
Tratamiento supresor (anti-tiroideo):
 Carbimazol (Neo Tomizol® en comprimidos de 5mg
Carbimazol (Neo Tomizol® en comprimidos de 5mg
Tiamazol (Tirodril®) en comprimidos de 5mg
Yoduro potásico en comprimidos de 100, 200 y 300mg.
PATOLOGÍAS AUTOINMUNES DE LA GLÁNDULA TIROIDES
Las más usuales, aunque no las únicas, son las dos siguientes:
- Tiroiditis de Hashimoto (bocio linfomatoso).- Descrito por Hakuro Hashimoto en el año 1912. Esta enfermedad autoinmune (anticuerpos que destruyen el tejido tiroideo) suele asociarse a otras patologías autoinmunes que afectan a otros órganos. El tratamiento es el de cualquier cuadro clínico hipotiroideo: Levotiroxina.
- Enfermedad de Graves Basedow.- Recibe su nombre del irlandés Robert Graves (1835) y el prusiano Karl Adolph von Basedow (1840). Se caracteriza por el desarrollo de anticuerpos contra los receptores tiroideos de la TSH. Ello da lugar a una mayor secreción compensatoria de TSH con la consiguiente hipersecreción de T4 y T3, desarrollándose un cuadro clínico de hipertiroidismo. El tratamiento es con fármacos anti-tiroideos. La enfermedad de Graves-Basedow representa aproximadamente el 80% de todas las tirotoxicosis diagnosticadas.
El cáncer de tiroides se trata en un informe independiente. Mencionar aquí que existen cuatro tipos diferenciados de cáncer tiroideo: papilar, folicular, medular y anaplásico. Su gravedad depende del estadio en el que se diagnostica, siendo el anaplásico la versión más agresiva.
MEDICAMENTOS QUE INTERFIEREN CON LA SECRECIÓN
- Bexaroteno, un retinoide de síntesis, induce la supresión de tirotropina (la hormona hipofisaria que estimula la síntesis y secreción de tiroxina) causando un hipotiroidismo de origen hipofisario en un 40 a 70% de los pacientes. Tras suspender el tratamiento, la función tiroidea normal se recupera al cabo de varias semanas. Bexaroteno (Targretín®) se formula en cápsulas de 75mg, estando indicada en el tratamiento del linfoma de células T/NK, mediante la inducción de la apoptosis de los linfocitos T cutáneos a través de la unión a los RXR (Retinoid X Receptors).
- Mitotano (Lysodrén® cápsulas de 100mg) se prescribe para el cáncer suprarrenal metastásico e inoperable. Es citotóxico pero sin causar apoptosis. Hasta donde se sabe, altera el metabolismo del cortisol. Causa un tipo de hipotiroidismo de origen central [hipotalámico e hipofisario] en el que las concentraciones de T4 disminuyen durante el primer trimestre del tratamiento. Muy frecuentemente es necesario tratamiento sustitutivo con Levotiroxina.
- «Inhibidores de checkpoint», incluyendo los «inhibidores de CTLA4» y los «inhibidores de PD-1». El efecto adverso de los «inhibidores de CTLA4» es la hipofisitis (inflamación de la hipófisis); y la disfunción de la glándula tiroides es característica de los «inhibidores de PD-1». En ambos casos el resultado es hipotiroidismo. [CTLA es el acrónimo de Cytotoxic T Lymphocyte Antigen; y PD es el acrónimo de Programmed Death]. Por ejemplo, la inyección de Ipilimumab (un «inhibidor de CTLA4») se asocia a una inflamación destructiva de la hipófisis (hipofisits) que da lugar a un grado variable de hipotiroidismo, insuficiencia adrenal e hipogonadismo; efecto adverso observado en un 3 a un 10% de los pacientes con melanoma tratados con dosis de 3mg/Kg cada 3 semanas durante 4 ciclos. El hipotiroidismo y su consiguiente disminución de la función de las glándulas adrenales debuta al cabo de entre 1 y 3 meses de iniciarse el tratamiento (entre el 2º y el 4º ciclo). La función de la glándula tiroides solo se recupera en la mitad de los pacientes tras finalizar el tratamiento. En cambio, la función adrenal se daña irreversiblemente. La resonancia magnética nuclear muestra un aumento del tamaño de la hipófisis (hipofisitis), a la vez que adelgazamiento del tallo que une la hipófisis con la glándula tiroides.
- Varios medicamentos disminuyen la secreción hipofisaria de tirotropina, sin disminución de los niveles de T4 en plasma (por lo tanto sin alteración de la función de la glándula tiroides). Los fármacos que más comúnmente desencadenan esta situación se hallan: glucocorticoides, agonistas dopaminérgicos (por ejemplo antiparkinsonianos), análogos de la somatostatina, y metformina.
MEDICAMENTOS QUE INTERFIEREN CON LA SÍNTESIS Y/O SECRECIÓN DE TIROXINA EN LA GLÁNDULA TIROIDES
El exceso de yodo intratiroideo inhibe la síntesis de tiroxina (hormona tiroidea): «efecto de Wolff-Chaikoff». El mecanismo parece deberse a la formación de derivados yodados (yodolactonas y yodoaldehídos) que inhiben la enzima peroxidasa. Además, el exceso de yodo da lugar a tirotoxicosis («fenómeno de Jod-Basedow»).
El excesivo aporte de yodo de tipo farmacológico procede de dos medicamentos: agentes de contraste (usados para tomografía computerizada y colecistografía); y Amiodarona.
En menor medida, también puede proceder del uso por vía tópica de povidona-yodada; así como de algunos productos publicitarios, incluyendo expectorantes, duchas vaginales y algunos preparados a base de algas marinas.
La Amiodarona es un antiarrítmico de la clase III que contiene (en peso) un 37,3% de yodo, que libera 7mg de yodo por cada comprimido de 200mg. Esta dosis es 45 veces la recomendación diaria de yodo para un adulto o una mujer no gestante, que es de 150mcg (150μg en la terminología antigua). El yodo liberado de la Amiodarona puede dar lugar tanto a hipotiroidismo como hipertiroidismo. A esta alteración de la función tiroidea debida al yodo presente en la molécula de Amiodarona se le denomina «tirotoxicosis inducida por Amiodarona tipo 1» (para distinguirla de la «tirotoxicosis por Amiodarona tipo 2»), ya que cada una se trata de manera diferente (véase más adelante en este mismo texto).
El uso de las sales de litio (tratamiento electivo para la estabilización de las fases maníacas en la enfermedad bipolar) causa gota e hipotiroidismo por disminución de la secreción de tiroxina en plasma como consecuencia de la inhibición de la pinocitosis (ver bajo el epígrafe introducción). En un estudio de pacientes con depresión maníaca, el 50% desarrollaron síntomas de gota (diagnosticados por ultrasonografía), y solo el 16% de los pacientes del grupo control (que no recibieron sales de litio). La prevalencia de hipotiroidismo entre los tratados con sales de litio es mayor en mujeres con una edad superior a 40 años.
MEDICAMENTOS QUE POTENCIAN LA AUTOINMUNIDAD DE LA HORMONA TIROIDEA
Los fármacos que potencian al sistema inmune (inmunoterapia anticancerosa) tienen el efecto colateral de incrementar el riesgo de enfermedades autoinmunes, entre ellas las disfunciones tiroideas autoinmunes.
La prevalencia de disfunción primaria del tiroides es de entre un 5 y un 10% de los pacientes tratados con «inhibidores del CTLA4»; y de entre un 10 y un 20% para aquellos tratados con «inhibidores de PD-1»; y superior a un 20% cuando se usan ambas terapias combinadas.
Muchos pacientes que son tratados con inmunoterapia presentan tiroiditis indolora que deriva en tirotoxicosis y termina en hipotiroidismo; y solo esporádicamente enfermedad de Graves-Basedow. La tirotoxicosis debuta a las 4 a 8 semanas durante los tratamientos con «inhibidores de PD-1»; al cabo de hasta 18 semanas durante los tratamientos con «inhibidores de CTLA4»; y a las 2 semanas aproximadamente en los tratamientos de combinación. Los casos de tirotoxicosis (y el subsiguiente hipotiroidismo) moderados o graves suelen ser irreversibles.
La disfunción tiroidea de estos fármacos de inmunoterapia («inhibidores de CTLA4» e «inhibidores de PD-1») es consecuencia de una disminución de la auto-tolerancia inmunitaria.
Las citoquinas inmunoestimulantes inespecíficas (interleucina-1, interferón-α) usados para el tratamiento del carcinoma renal metastásico, melanoma y hepatitis C, causan hipotiroidismo en un porcentaje de pacientes entre el 15 y el 50%. El cuadro debuta con tiroiditis, seguido por tirotoxicosis e hipotiroidismo.
Alemtuzumab es un anticuerpo monoclonal humanizado dirigido contra el epítopo CD52. [CD es el acrónimo de Cluster of Differentation]. Como consecuencia se produce una depleción de la carga de células B y células T con resultado de un aumento de la frecuencia de enfermedad tiroidea autoinmune, observada sobre todo en pacientes de esclerosis múltiple.
Otros escenarios clínicos que pueden desencadenar una enfermedad autoinmune del tiroides incluyen el tratamiento antirretrovial contra la infección por VIH (tras la normalización del sistema inmune), pacientes que han padecido enfermedad de Cushing, y, ocasionalmente, durante el período de postparto.
MEDICAMENTOS QUE DAÑAN DIRECTAMENTE LA GLÁNDULA TIROIDES
- Amiodarona causa una tiroiditis destructiva a la que se denomina «tirotoxicosis tipo 2 inducida por Amiodarona». Afecta a entre el 5 y el 10% de los pacientes. Este efecto se debe a una acción directa del medicamento sobre las células de la glándula (tirocitos). Este efecto de la Amiodarona es distinto (aunque indistinguible clínicamente) de la «tirotoxicosis tipo 1 por Amiodarona», debida al yodo contenido en la molécula. Los pacientes afectados por «tirotoxicosis tipo 1 por Amiodarona» manifiestan taquicardia o arritmia, una palpación dura de la glándula (recuérdese que ésta se halla muy superficial), aumentos de los niveles plasmáticos de T4 y T3, y disminución de la TSH en sangre. Mientras la tirotoxicosis tipo 1 [inducida por Amiodarona] se trata con medicamentos anti-tiroideos, la tirotoxicosis tipo 2 [inducida por Amiodarona] se trata con glucocorticoides. Dada la dificultad de distinguir el tipo de tirotoxicosis por Amiodarona, se suelen administrar ambos fármacos (anti-tiroideos y glucocorticoides).
- Los «inhibidores de la tirosina-quinasas» (un tipo de terapia antineoplásica dirigida) incrementa el riesgo de tiroiditis. De todos los fármacos de este grupo, la mayor frecuencia se observa con Sunitinib (indicado para el tratamiento del carcinoma renal metastásico, y los tumores del estroma gastrointestinal). El mecanismo por el que los «inhibidores de la tirosina-quinasa» causan tiroiditis (® tirotoxicosis ® hipotiroidismo) está relacionado con la isquemia resultante de la inhibición del VEGFR (Vascular Epithelial Growth Factor Receptor).
MEDICAMENTOS QUE INTERFIEREN CON LA UNIÓN DE LA TIROXINA CON PROTEÍNAS PLASMÁTICAS
La tiroxina (T3 y T4) circulan en sangre asociadas a una proteína de tipo globular denominada tiroglobulina.
Algunos medicamentos aumentan la unión de la tiroxina a la tiroglobulina; otros disminuyen esta unión.
Los estrógenos (naturales y de síntesis), Metadona, Mitotano y 5-Fluorouracilo incrementan la unión de la tiroxina a la tiroglobulina.
En cambio, los andrógenos, glucocorticoides y la niacina, disminuyen la unión de la tiroxina a la tiroglobulina.
El efecto más notorio se produce con los estrógenos: en pacientes tratados con estrógenos un mayor porcentaje de T4 se unirá a la tiroglobulina (incluso si los niveles de T3 en plasma son bajos). Por lo tanto, si el paciente requiere tiroxina exógena, será necesario incrementar la dosis administrada. En cambio, en pacientes normotiroideos, el tiroides compensará la menor cantidad de T4 libre aumentando la síntesis de hormona. [Esta interacción no afecta a los parches transdérmicos de estrógenos debido a que el estrógeno liberado del parche no sufre el efecto de primer paso hepático.
Algunos fármacos (antiepilépticos, antiinflamatorios no-esteroides, Furosemida (a dosis elevadas) y heparina, desplazan a la T4 de la tiroglobulina. Esta interacción no tiene trascendencia clínica; como mucho, se puede producir interferencia en las determinaciones analíticas de la función tiroidea (solo con los antiepilépticos y la heparina).
MEDICAMENTOS QUE INTERFIEREN CON LA ACTIVACIÓN, METABOLISMO Y EXCRECIÓN DE LA TIROXINA
La conversión enzimática T4 ® T3 (pérdida de un átomo de yodo) es inhibido por varios fármacos: Amiodarona, Dexametasona (y otros glucocorticoides), Propranolol (a dosis elevadas), Propiltiouracilo (un fármaco anti-tiroideo), y contrastes para técnicas colecistográficas.
Haciendo virtud de la necesidad, la Dexametasona se utiliza para el tratamiento de pacientes con grave tirotoxicosis.
Varios medicamentos (Fenobarbital, Fenitoína, Carbamacepina y Rifampicina) inducen el metabolismo de Levotiroxina, haciendo necesario, en algunos casos, aumentar la dosis.
Los «inhibidores de la tirosina-quinasas» también aumentan la tasa de metabolismo de la hormona tiroidea.
Los medicamentos quelantes («secuestrantes») de ácidos biliares (Colestiramina, Colestipol y otros) interfieren con la recirculación enterohepática de la hormona tiroidea.
MEDICAMENTOS QUE AFECTAN A LA ABSORCIÓN DE LOS PREPARADOS FARMACÉUTICOS DE HORMONAS TIROIDEAS
Los comprimidos de Levotiroxina (Eutirox®) precisan un medio ácido para su disolución previa a su absorción en el intestino delgado. Ingerida en ayunas, entre el 60 y el 80% de una dosis estándar de Levotiroxina se absorbe al cabo de 2 a 4 horas. Así pues, los medicamentos que interfieren con la absorción gastrointestinal de Levotiroxina son: «inhibidores de la bomba de protones», sulfato ferroso, carbonato cálcico, hidróxidos de aluminio, Sucralfato, «quelantes de ácidos o sales biliares», y Raloxifeno. En estas circunstancias, o bien se espacia la toma de cualquiera de estos medicamentos y Levotiroxina unas 4 horas, o bien la Levotiroxina se administra por la noche, a la hora de acostarse, unas 2 horas después de la cena. Alimentos como la leche o el café también interfieren con la absorción de Levotiroxina.
MEDICAMENTOS QUE MODIFICAN LOS PARÁMETROS BIOQUÍMICOS DE FUNCIÓN TIROIDEA
Test de función tiroidea
- TSH: 0,5↔4,7μU/ml
- TSH es el mejor parámetro para valorar el hipotiroidismo o hipertiroidismo.
- Si TSH> rango normal ® determinar T4 para confirmar el diagnóstico de hipotiroidismo.
- Si evidencia clínica de hipotiroidismo, T4 y T3 elevadas, pero TSH normal ® posible hipopituitarismo.
- TSH < rango normal ®
- T4 (total, esto es, libre + unida a proteínas plasmáticas): adultos: 4↔9,5μg/dL (51↔122mmol/L); mujeres tomando suplementos estrogénicos: 6,5↔12,5μg/dL (84↔161mmol/L)
- Más del 95% de la T4 está unida a proteínas plasmáticas (tiroglobulina y albúmina). El 5% restante es biológicamente activo. Para valorar correctamente la función tiroidea es necesario conocer la fracción libre (no unida a proteínas), junto con la TSH.
- T4 elevado: hipertiroidismo, tiroiditis aguda, embarazo, primeros estadios de la hepatitis, uso de estrógenos.
- T4 disminuido: hipotiroidismo, tiroiditis, nefrosis, cirrosis, hipoproteinemia, malnutrición, y con algunos medicamentos (ver más adelante en este texto).
- T4 libre (no unida a proteínas del plasma): 0,8↔2,7ng/dL (0,010↔0,035nmol/L
- T3: 45↔137ng/dL (0,69↔2,10nmol/L)
- T3 es más activa metabólicamente que T4, pero tiene más breve vida media. La determinación de T3 tiene escaso valor diagnóstico para el hipotiroidismo. Sin embargo, es útil para el diagnóstico del hipertiroidismo y la tirotoxicosis.
- – La biotina tiene tres aplicaciones: (1) tratamiento de los desórdenes neuromusculares en enfermedades como la esclerosis múltiple; (2) forma parte de suplementos nutricionales «de venta libre»; y (3) se usa en laboratorios para llevar a cabo complejas técnicas analíticas (radioinmunoensayo). En todos estos casos, se producen interferencias con determinaciones analíticas de la función tiroidea: niveles falsamente bajos de tirotropina (TSH), niveles falsamente elevados de T4; y resultados engañosos de anticuerpos contra el receptor de la tirotropina que inducirían a pensar en una posible enfermedad de Graves-Basedow.
- Amiodarona.- Como se ha explicado en párrafos anteriores, la Amiodarona da lugar a tirotoxicosis y subsiguiente hipotiroidismo. Así mismo, este medicamento falsea los resultados de los test de función tiroidea. La inhibición de la conversión T4 ® T3 conduce a unos valores bajos (tanto en plasma como intrahipofisariamente) de T3 por fallo del mecanismo de retroalimentación negativa. El resultado neto es: de la TSH (tirotropina) y T4; junto a ¯ T3. Todos estos cambios se pueden confundir con una tirotoxicosis primaria. Estas observaciones se podrían considerar como adenoma del tejido tiroideo secretor de TSH, o bien un resistencia a la acción de la hormona.
- – La heparina (tanto la no-fraccionada como la heparina de bajo peso molecular) libera lipoproteína-lipasa. Esta mayor actividad enzimática persiste en las muestras de sangre (in vitro) Los ensayos de actividad tiroidea, sobre todo si se han incubado durante un período de tiempo suficiente, causan valores engañosos. Téngase en cuenta que los ácidos grasos libres desplazan a la tiroxina (T4 y T3) de la tiroglobulina (proteína transportadora).
- Fenitoína, Carbamacepina y Salsalato.- La Fenitoína y la Carbamacepina incrementan el metabolismo de la tiroxina y desplazan a la T4 de la tiroglobulina. El aumento de T4 en plasma frena la secreción hipofisaria de TSH (tirotropina). Se trata de una alteración transitoria que se normaliza cuando se establece un nuevo equilibrio.
EFECTOS DE LA FUNCIÓN TIROIDEA SOBRE EL METABOLISMO DE FÁRMACOS
- El hipertiroidismo acelera el metabolismo de algunos medicamentos: Propranolol, glucósidos cardíacos y glucocorticoides.
- El hipotiroidismo retrasa el aclaramiento plasmático (clearance) de los fármacos mencionados.
Zaragoza, a 3 de diciembre de 2019
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Farmacia Las Fuentes
Florentino Ballesteros, 11-13
50002 Zaragoza


