HEPATITIS C
CONSIDERACIONES PREVIAS SOBRE LOS VIRUS HEPATOTROPOS MÁS FRECUENTES.-
Aun cuando en alguna literatura científica se mencionan cinco tipos de virus causantes de hepatitis infecciosa (A, B, C, D y G), en este informe solo se consideran los virus hepatotropos A, B y C (este último denominado durante muchos años «no-A-no-B»).
Los virus de la hepatitis A y B se identificaron a comienzos de la década de 1960; comercializándose la primera vacuna frente al virus de la hepatitis B (Engerix-B®) en 1986; y la primera vacuna frente al virus de la hepatitis A (Havrix®) en 1997.
Entre los virus de la hepatitis A, B y C existen diferencias importantes: el virus de la hepatitis A se contagia por vía oral, da lugar a una hepatitis aguda, nunca crónica, y se detecta muy fácilmente en sangre. En cambio, el virus de la hepatitis B se contagia a través de trasfusiones de sangre o la administración de hemoderivados; más raramente por contacto sexual. Por esta razón, en la época en que solo se sabía de la existencia de dos virus hepatotropos (A y B), a la infección causada por el segundo (B) se le denominaba hepatitis «sérica».
El virus de la hepatitis A pertenece a la familia Enteroviridae.
El virus de la hepatitis B se ha incluido en la familia taxonómica Hepadnaviridae.
El virus de la hepatitis C pertenece a la familia Flavoviridae (la misma familia a la que pertenecen el virus del dengue, la fiebre amarilla y la rubéola).
Mientras los virus de la hepatitis A y C tienen ARN como material genético, el virus de la hepatitis B es un adenovirus (ADN como material genético).
HEPATITIS C
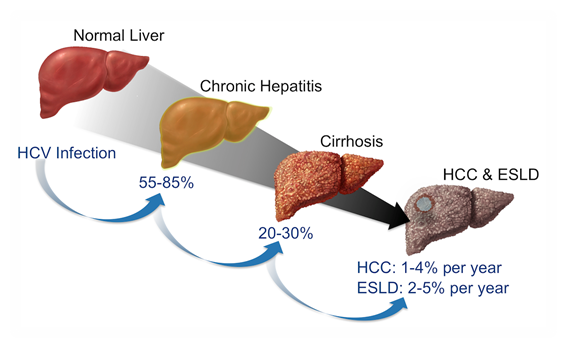
La hepatitis C (antiguamente denominada noA-noB, descripción abarcaba también a otros potenciales virus hepatotropos) es una infección hepática, aguda o crónica. El número de afectados a escala global (datos de 2019) se estima en aproximadamente 170 millones de personas (~3% de la población mundial), con una mortandad anual de más de 350.000. Sin tratamiento, la hepatitis C puede dar lugar a insuficiencia hepática; y, a largo plazo, cirrosis o cáncer de hígado primario en un porcentaje de entre el 15% y el 30% de los afectados.
Once países aglutinan alrededor del 50% de todos los casos de hepatitis C crónicas. Son: Brasil, Egipto (donde la prevalencia es la más alta del mundo), China, India, Indonesia, Mongolia, Myanmar, Nigeria, Paquistán, Camerún, Uganda y Vietnam. En la Unión Europea, la prevalencia de la hepatitis C es de 7,3 casos por cada 100.000 habitantes, si bien la incidencia en España es mayor, aproximadamente 2% de la población.
El virus de la hepatitis C se caracteriza por una elevada tasa de mutaciones. Se han identificado 7 genotipos diferentes, de los que cuatro (1a, 1b, 2a y 3a) son los más prevalentes en todo el mundo, y explican gran parte de las hepatitis infecciosas en países desarrollados.
El genotipo 1 (1a, 1b) es el de mayor distribución mundial. Mientras los genotipos 4, 5 y 6 tienen una prevalencia mucho más limitada: el genotipo 4 es común en África y Oriente Medio; el genotipo 5 es especialmente prevalente en Sudáfrica; y el genotipo 6 en el Sudeste de Asia.
En España el 70% de los enfermos están infectados con el genotipo 1; seguido por el genotipo 3 (alrededor del 16%), el más refractario al tratamiento; y el resto por los demás genotipos en proporciones menores. La incidencia es mayor en hombres que en mujeres, y más frecuente en el grupo etario de 25 a 44 años.
El virus de la hepatitis C da lugar a una infección aguda, bien asintomática o con una sintomatología anodina (leve ictericia, náuseas, malestar inespecífico). En aproximadamente una tercera parte de los pacientes, el virus no desaparece del hígado, y su persistencia torna la infección en crónica. Una hepatitis aguda puede tardar varios años en hacerse crónica. Es en este estadio cuando, transcurridos varios años (alrededor de tres décadas), puede derivar en cirrosis (alrededor del 20-30% los enfermos) y/o cáncer hepático primario (aproximadamente el 5% de los infectados con hepatitis crónica).
ESLD: End Stage Liver Disease
Las hepatitis C y B son la causa más frecuente de cirrosis hepática y trasplante de hígado.
Así mismo, la hepatitis vírica tipo C incrementa la probabilidad de sufrir patología extrahepática, tal como crioglobulinemia y linfoma no-Hodking.
[La crioglobulinemia es una condición común a diversas enfermedades, tales como determinadas infecciones, lupus eritematoso sistémico, y macroglobulinemia de Walldenström, entre otras. Su denominación procede de la tendencia a formarse precipitados de proteínas a bajas temperaturas que da lugar a un eritema característico, especialmente manifiesto en manos y pies].
Las complicaciones más comunes de la hepatitis C crónica incluyen: descompensación hidrópica (signo patognomónico de cirrosis), varices esofágicas (debido a hipertensión portal), hemorragias, y encefalopatía hepática (por acumulación en el tejido cerebral de derivados tóxicos del metabolismo proteico).
El diagnóstico diferencial es la detección de anticuerpos anti-HVC (anticuerpos contra el virus). El criterio de resolución clínica de la hepatitis C es la no-detección del ARN vírico al cabo de 12 y 24 semanas de la conclusión de los tratamientos.
La importancia de la hepatitis vírica C se infiere del riesgo de contagio. En 1989 el riesgo de contagio siguiendo una trasfusión sanguínea era del 1% para el virus de la hepatitis C, mientras el riesgo de contagio para el VIH era de 1 por millón de trasfusiones.
En el año 1989, investigadores de la empresa biotecnológica Chiron Corporation lograron clonar el genoma del virus de la hepatitis C. A este avance le siguieron otros no menos trascendentes: Ortho Diagnostique System (filial de la multinacional Johnson & Johnson) comercializó un test serológico para la detección del virus de la hepatitis C. La prueba es específica para el 80% aproximadamente de los infectados. Los casos de negatividad parecen deberse a variaciones genotípicas no tipificadas del virus.
El aislamiento de los virus causantes de las hepatitis A y B fue relativamente simple; no así el del virus de la hepatitis C. Se consiguió mediante la tecnología denominada «genética inversa», con la que también se logró el aislamiento e identificación del gen de la muscoviscidosis (fibrosis quística) en el año 1989.
Ralf F.W. Bartenschlager, virólogo de la universidad de Heidelberg, Alemania, y Charles M. Rice, virólogo de la Rockefeller University, en New York diseñaron una tecnología para la replicación del virus de la hepatitis C en cultivos celulares in vitro. Por este avance científico fueron galardonados con el Lasker DeBakey Clinical Medical Research Award. El reconocimiento fue compartido ex aequo Michael J. Sofia por el descubrimiento de un trascendente y eficaz medicamento contra la hepatitis C, el Sofosbuvir.
Ralf F. W. Bartenschlager y Michael M. Rice iniciaron su trabajo en 1989, tras haberse conseguido por primera vez la secuenciación del genoma del virus.
Los primeros intentos, llevados a cabo por Michael M. Rice y colegas japoneses, consistentes en la inserción del ARN vírico en células en cultivo fracasaron repetidamente. Fue la intervención de R. F. W. Bartenschlager, entonces la universidad de Mainz Johannes Gutenberg (Alemania), la que finalmente hizo factible la replicación in vitro (en células en cultivo infectadas) del virus de la hepatitis C.
Este trabajo sentó las bases para que Michael J. Sofia, entonces en los laboratorios Arbutus Biopharma comenzara un programa de investigación de potenciales medicamentos contra la hepatitis C. En el año 2005, M. J. Sofia se había trasladado a laboratorios Pharmasset, una empresa farmacéutica creada en 1998, adquirida en 2011 por Gilead Sciences previo desembolso de 11.2 billones de dólares. Fue allí donde obtuvo el trascendente medicamento: Sofosbuvir.
El laboratorio Pharmasset Ltd., se había creado para la investigación de tratamientos farmacológicos antivirales. El grupo de investigación de Pharmasset, dirigido por Michael Sofia, patentó el producto en el año 2003. En un principio se pensó sintetizar una versión modificada de un producto de la «pipeline» de la empresa farmacéutica. Se trataba del designado como PSI-6630. El que, andando el tiempo, llegaría a ser Sofosbuvir era de hecho un intermediario en la última etapa en la síntesis del nucleósido modificado PSI-6630.
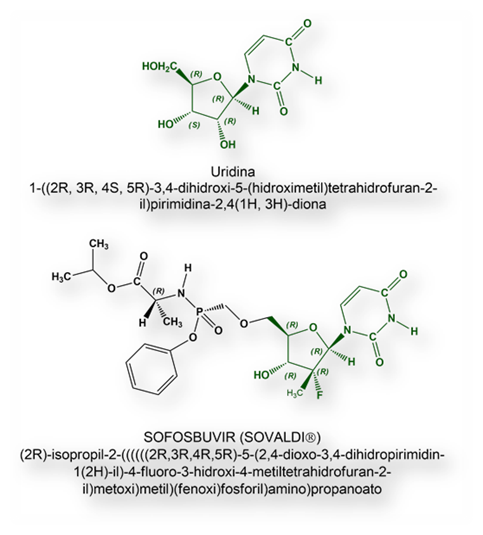
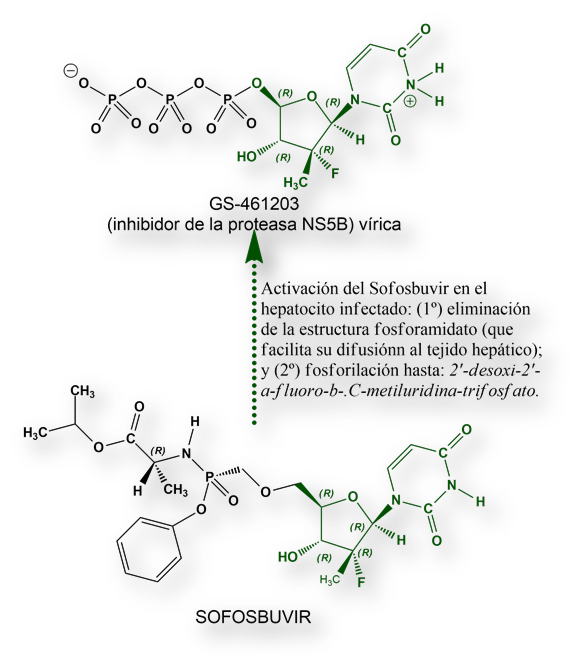 Sofosbuvir es un profármaco que, una vez dentro del hígado, se metaboliza en la molécula farmacológicamente activa, designada como GS-461203, un sosia del trifosfato de uridina que, al incorporarse a la cadena de ARN en formación de los nuevos viriones, la síntesis se interrumpe.
Sofosbuvir es un profármaco que, una vez dentro del hígado, se metaboliza en la molécula farmacológicamente activa, designada como GS-461203, un sosia del trifosfato de uridina que, al incorporarse a la cadena de ARN en formación de los nuevos viriones, la síntesis se interrumpe.
Sofosbuvir es un ácido débil con una constante de disociación (pKa = 9,3) En la Biopharmaceutical Classification System, Se encuadra en la clase 3, esto es, elevada hidrosolubilidad y, consecuentemente, baja permeabilidad a través de las membranas celulares.
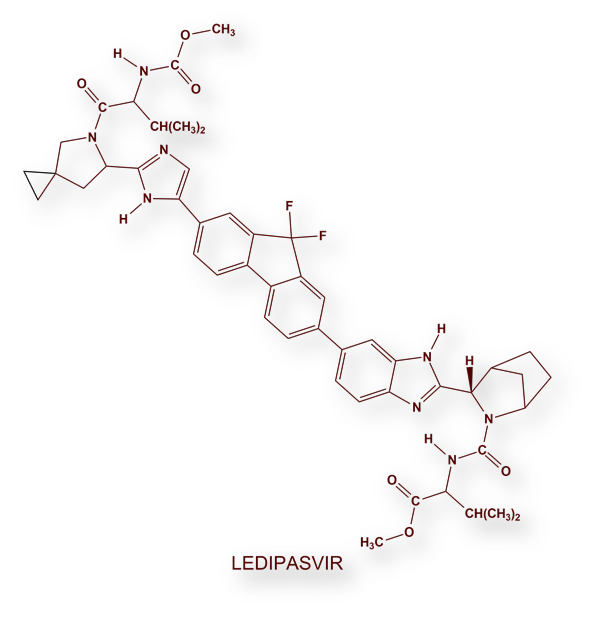
Su excelente trabajo del grupo dirigido por Michael Sofia condujo al fármaco Sofosbuvir (Sovaldi®), capaz de erradicar el virus de la hepatitis C sin efectos adversos graves. La Food and Drug Administration (FDA) estadounidense autorizó Sovaldi® (Sofosbuvir) en el año 2013. Desde entonces se han comercializado otros medicamentos (véase más adelante en este texto) o asociaciones (Harvoni® [Sofosbuvir + Ledipasvir], es un ejemplo), con índices de curación de entre 94% y 99%, impensables con los tratamientos más antiguos; y, además, en un tiempo relativamente breve, de entre 8 y 12 semanas.
Hasta hace una década los dos únicos fármacos disponibles para el tratamiento de la hepatitis C eran peginterferón-α-2a y Ribavirina. Los índices de curación dependían del genotipo, entre un 50% para el genotipo 1 (el más frecuente en España) y un 80% para los genotipos 2 y 3 (mucho menos comunes). La dificultad para el cultivo in vitro de células infectadas con el virus de la hepatitis C fue la traba más notable para el desarrollo de medicamentos antivirales de acción directa.
En el año 2011 se comercializaron es España los dos primeros medicamentos de una nueva clase farmacológica, «inhibidores selectivos y reversibles de un tipo de proteasa» (en este caso: NS3). NS es el acrónimo de Non-Structural [proteins]. Se trataba de Boceprevir y Telaprevir. Estos dos medicamentos se usaron durante un tiempo, siempre asociados a peginterferón-α2a y Ribavirina («triple terapia»), consiguiéndose curaciones microbiológicas (no detección de ARN vírico en sangre) en un 70% de los enfermos. Sin embargo, las interacciones farmacológicas y los efectos adversos daban lugar a frecuentes suspensiones de los tratamientos. Finalmente, Boceprevir y Telaprevir se retiraron del mercado farmacéutico español.
En el año 2014 se comercializaron medicamentos «inhibidores de la proteasas» NS5A (Daclatasvir), NS5B (Sofosbuvir); y de las proteasas y NS3 y NS4A (Simeprevir). Con estos medicamentos se conseguía una curación en el 80% de los casos con independencia del genotipo del virus de la hepatitis C.
Todos los inhibidores de las distintas proteasas comparten el mecanismo de acción: inhibición de la replicación vírica.
El genoma del virus de la hepatitis C codifica una proteína de 3.011 aminoácidos. Ésta se hidrolizada en proteínas de menor tamaño: «proteína nuclear», E1, E1 (proteínas de la envoltura de la cápside); y siete proteínas NS (Non Structurals [proteins]), designadas como NS1/p7, NS2, NS3, NS4A, NS4B, NS5A y NS5B.
La cápside viral está formada por la proteína nuclear, y su envoltura por las glucoproteínas E1 y E2, Las proteínas no estructurales (NS) son necesarias para la replicación viral. Estas proteínas, en conjunción con proteínas de la célula infectada, llevan a cabo la replicación del genoma vírico y, en última instancia, la formación de nuevas partículas víricas.
Siguiendo la metodología de inhibir las proteasas del VIH en el tratamiento del SIDA, que tan buenos resultados produjo, en el abordaje de la infección por el virus de la hepatitis C se siguió un procedimiento similar. Y, de este modo, los primeros «inhibidores de la proteasa» contra la hepatitis C (Boceprevir y Telaprevir) tenían como diana las proteasas NS3A y NS4A.
En el año 1996 se descifró la estructura y actividad de la proteasa NS5B, con actividad de polimerasa que, de este modo, se convirtió en una atractiva diana farmacológica. Una ventaja adicional derivada de su trascendente función, era la mínima variación genética en relación a otras proteasas, hecho que limitaría la aparición de resistencias de los potenciales medicamentos inhibidores.
De este modo se diseñaron dos grupos de inhibidores: «inhibidores nucleótidos/nucleósidos»; e «inhibidores no-nucleótidos/nucleósidos». Mientras los primeros actúan en el centro activo de la polimerasa vírica (NS5A), los segundos interacción de manera alostérica, esto es, en lugares diferentes del enzima modificando su conformación y, de resultas, su actividad como polimerasa.
Resumiendo:
- Inhibidores de las proteasas NS5A / NS3 /NS4A
- Ombitasvir / Pariteprevir (+ Ritonavir): Viekira®
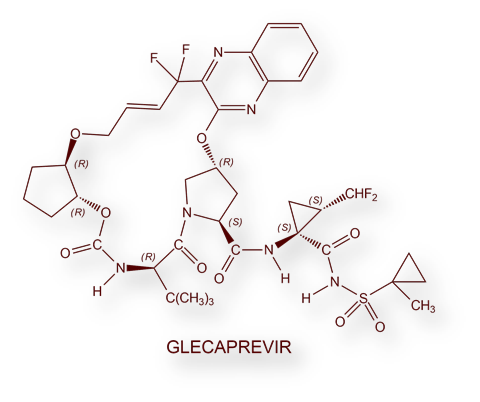
- Pibrentasvir / Glecaprevir:: Maviret®
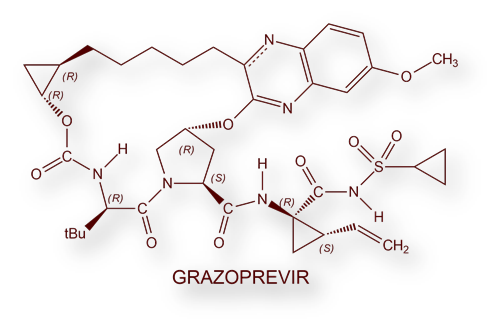
- Elbasvir / Grazoprevir: Zepatier®
- Inhibidores de las proteasas NS5A / NS5B
- Ledipasvir / Sofosbuvir: Harvoni®
- Velpatasvir / Sofosbuvir: Epclusa®
- Inhibidores de las proteasas NS5A / NS5B / NS3 / NS4A
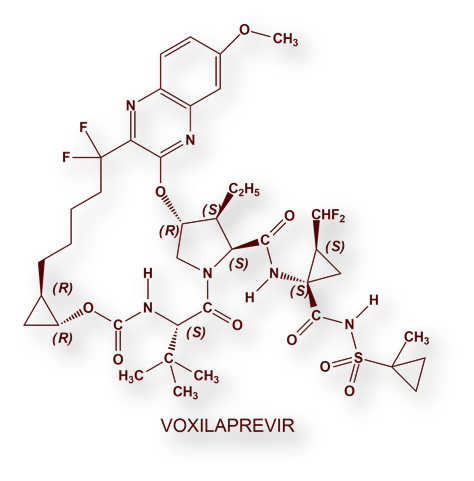
- Velpatasvir / Sofosbuvir / Voxilaprevir: Vosevi®
Entre todos los medicamentos mencionados, Sofosbuvir es paradigmático. Es un inhibidor de la proteasa NS5B (una enzima polimerasa dependiente del ARN vírico). Para ser farmacológicamente activo, tras la eliminación de un fragmento molecular fosforamidato, requiere la adición de tres grupos fosfato. En esta configuración compite con el uridilato en la incorporación a la cadena del ARN vírico en formación. Cuando se inserta GS-461203 (verdadero principio activo del Sofosbuvir) en lugar de uridilato, la síntesis del ARN vírico se interrumpe.
Cuando Sofosbuvir se administra en combinación con peginterferón-α-2a y Ribavirina, en ciclos de tratamiento de 24 semanas de duración, los índices de curación microbiológica (no detección en sangre de ARN vírico) oscilan entre un 80% y más del 90%, en función de si el paciente tiene, o no, cirrosis o una extensa fibrosis hepática.

 Hay otros posibles medicamentos, pendientes de autorización por la Agencia Europea del Medicamento (European Medicine Agency), también inhibidores de algunas de las proteasas víricas. Los dos que se hallan en un estadio más avanzado de revisión son: asunaprevir y deleobuvir.
Hay otros posibles medicamentos, pendientes de autorización por la Agencia Europea del Medicamento (European Medicine Agency), también inhibidores de algunas de las proteasas víricas. Los dos que se hallan en un estadio más avanzado de revisión son: asunaprevir y deleobuvir.
Otra línea de investigación es el desarrollo de una vacuna frente a la hepatitis C (tal como ya existe para las hepatitis B y A). El principal problema para lograrlo es la elevada variabilidad genómica del virus de la hepatitis C.
De todas las que se hallan en fase de estudio, la IG4040 (designación preclínica) es la que se halla en un estadio de investigación más avanzado. Se trata de una vacuna basada en el virus Ankara genéticamente modificado que bloquea las proteasas víricas NS3, NS4 y NS5.
En las infecciones por el virus de la hepatitis C no hay evidencias que justifiquen la administración de inmunoglobulinas inespecíficas.
Bibliografía recomendada:
- Lee C. Daclatasvir: potential role in hepatitis C. Drugs Des Devel Ther 2013; 7: 1223-33.
- Herbst DA, Reddy KR. NS5A inhibitor, Daclatasvir for the treatment of chronic hepatitis C virus infection Expert Opin Invest Drugs 2013; 22; 1337-46.
- Poole RM. Daclatasvir + Asunaprevir: first global approval. Drugs 2014; 74: 1559-71
Bibliografía recomendada:
- Gentile I., et al. Ledipasvir: a novel synthetic antiviral for the treatment of HCV infection. Expert Opin Invest Drugs 2014; 23: 561-71.
- Afdhal N., et al. ION-2 Investigators. Ledipasvir and Sofosbuvir for previously treated HCV genotype infection. N Engl J Med 2014; 370: 1483-93.
Bibliografía recomendada:
- Bonaventura A, Montecucco F. Sofosbuvir / Velpatasvir: a promising combination. World J Hepatol 2016; 8: 785-9.
- Keating GM. Elbasvir/Grazoprevir: first global approval. Drugs 2016; 76: 617-24.
Zaragoza, a 6 de noviembre de 2019
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Zaragoza