ANTECEDENTES
 La historia de la ciclosporina se inicia en el año 1969 partiendo de una muestra de tierra de Hardanger Vidda, una región del sur de Noruega. De esta muestra de tierra se aísla un hongo, Tolypocladium inflatum Gams (sinonimia: Beauveria nivea), de la que se extraen dos sustancias que muestran una actividad anti-fúngica y antibiótica residual, insuficiente para pensar en cualquier aplicación farmacéutica. No obstante, teniendo en cuenta la mínima toxicidad de estas sustancias, se decidió realizar un cribado farmacológico en busca de posibles aplicaciones terapéuticas. Es así como se desvelaron dos acciones: la actividad depresora de la inmunidad (grupo de trabajo de Jean-François Borel) y citostática (grupo de trabajo dirigido por Hartmann Stähelin).
La historia de la ciclosporina se inicia en el año 1969 partiendo de una muestra de tierra de Hardanger Vidda, una región del sur de Noruega. De esta muestra de tierra se aísla un hongo, Tolypocladium inflatum Gams (sinonimia: Beauveria nivea), de la que se extraen dos sustancias que muestran una actividad anti-fúngica y antibiótica residual, insuficiente para pensar en cualquier aplicación farmacéutica. No obstante, teniendo en cuenta la mínima toxicidad de estas sustancias, se decidió realizar un cribado farmacológico en busca de posibles aplicaciones terapéuticas. Es así como se desvelaron dos acciones: la actividad depresora de la inmunidad (grupo de trabajo de Jean-François Borel) y citostática (grupo de trabajo dirigido por Hartmann Stähelin).
Durante la década de 1960, el laboratorio Sandoz había desarrollado dos ensayos estandarizados, uno para estudiar la inhibición de la síntesis de anticuerpos (tras la inyección de hematíes de carnero como fuente de antígenos), y otro para valorar la supervivencia de los animales tras la inoculación de células leucémicas.
Las sustancias del extracto del hongo (Tolypocladium inflatum) inhibían la formación de anticuerpos, sin impedir la multiplicación de las células leucémicas inoculadas en ratones). El hallazgo (1972) era sorprendente: se trataba de sustancias capaces de inhibir la respuesta inmunitaria, pero no bloqueando la proliferación celular. Como mínimo, estas sustancias podrían ser muy valiosas como herramienta de investigación. De las dos sustancias se eligió una de ellas, la más prometedora.
Al año siguiente, 1973, Rüegger (Sandoz, Basilea, Confederación Helvética) aisló y purificó la sustancia activa del extracto de Tolypocladium inflatum. Se le denominó ciclosporina-A (en adelante: ciclosporina).
En 1975, Petcher y Rüegger determinaron la estructura tridimensional de la ciclosporina, mediante cristalografía de rayos X.
En 1980, un grupo de investigadores de Sandoz, dirigido por R. Wenger, consiguió la síntesis de la molécula en el laboratorio. La obtención de la ciclosporina por síntesis no es económicamente rentable, de modo que su obtención a escala industrial se lleva a cabo en tanques de fermentación En un principio, el problema principal era separar la ciclosporina-A (sustancia activa) del conjunto de ciclosporinas obtenidas en los tanques de fermentación. En la actualidad, la modificación genética de las cepas del hongo hace posible la extracción y purificación por cromatografía de ciclosporina-A con una pureza superior al 98%.
La estructura de la ciclosporina (véase al comienzo del artículo) tiene algunas particularidades: contiene un aminoácido inhabitual, designado MeBmt, muy importante para la actividad farmacológica; otros dos aminoácidos (α-aminobutírico y metilvalina) son así mismo fundamentales para su actividad biológica.
A partir del año 1972, diversos experimentos en animales demostraron la indubitada importancia de la ciclosporina en la prevención del rechazo a trasplantes y en el tratamiento de enfermedades autoinmunes.
Los estudios clínicos en el hombre se iniciaron en el año 1977.
El desarrollo preclínico de la ciclosporina sufrió dos reveses importantes.
El primero fue que la sustancia encapsulada en forma de polvo apenas se absorbía en el tracto intestinal.
Jean François Borel formuló la ciclosporina en una mezcla con un detergente (Tween-80®), etanol puro (95º) y una alícuota de agua. Con esta formulación, tras la administración de 500mg de ciclosporina, al cabo de 2 horas se conseguía una concentración sanguínea de apenas 1mcg/ml. Era muy poco, pero suficiente para demostrar que la molécula se podía absorber por vía oral. El alcohol puro como excipiente se sustituyó por aceite de oliva sin que se modificase la biodisponibilidad.
Un segundo revés surgió desde los primeros estadios de los ensayos clínicos, en 1978.
Roy Calne notificó que la eficacia de la ciclosporina se asociaba con una inaceptable toxicidad renal. Además, se comunican varios casos de linfomas, un tumor de los ganglios linfáticos. A raíz de estos dos hallazgos se interrumpieron los ensayos clínicos en espera de una solución que previniese estos graves efectos adversos. [Referencia bibliográfica: Calne R. Y., et al. Lancet ii 1979: 1033].
Pronto se halló la razón de la toxicidad. Las dosis usadas en el hombre (extrapoladas a partir de las usadas en perros durante la experimentación animal) se demostraron excesivas. Cuando se utilizaron dosis menores (17 a 25mg/Kg, día), la ciclosporina se mostraba eficaz sin toxicidad renal ni propensión al desarrollo tumoral.
Finalmente, la ciclosporina se comercializó con el nombre de Sandimmun® en el año 1983 con la indicación de prevención del rechazo tras el trasplante de órganos sólidos o de médula ósea.
CONCEPTOS BÁSICOS DE INMUNOLOGÍA
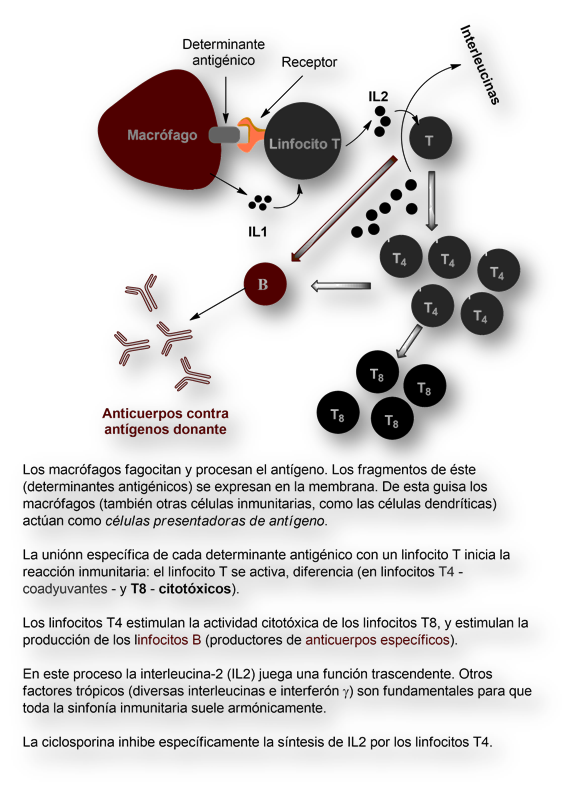 Cuando se trasplanta un tejido u órgano se genera una reacción de rechazo por parte del hospedador hacia el tejido injertado u órgano trasplantado. La reacción de rechazo tiene lugar, descrito en pincelas gruesas, del siguiente modo:
Cuando se trasplanta un tejido u órgano se genera una reacción de rechazo por parte del hospedador hacia el tejido injertado u órgano trasplantado. La reacción de rechazo tiene lugar, descrito en pincelas gruesas, del siguiente modo:
Los macrófagos captan los antígenos del donante, degradándolos a fragmentos (determinantes antigénicos), que se exponen en la membrana externa, donde se asocian a moléculas del denominado «complejo mayor de histocompatibilidad». Los macrófagos se convierten así en «células presentadoras de antígeno».
[Las moléculas del complejo mayor de histocompatibilidad se denominaron inicialmente HLA (Human Leucocyst Antigen), descubiertas por Jean Dausset, hallazgo reconocido con el Premio Nobel de Fisiología y Medicina en el año 1980 ex aequo Baruj Benacerraf y George D. Snell].
Las «células presentadoras de antígenos» interaccionan con linfocitos T que expresan receptores capaces de acomodar cada determinante antigénico, una reacción de gran especificidad. De resultas de esta interacción se produce la activación seguida de la diferenciación y proliferación de los linfocitos T. Se forma un clon de linfocitos T [un clon para cada determinante antigénico]. Algunas células T activadas se diferencian en una estirpe denominada T helper (células T coadyuvantes o T4).
Los linfocitos T coadyuvantes estimulan la actividad de otra estirpe de linfocitos T denominados linfocitos T citotóxicos (a veces designados como T8).
Además, los linfocitos T4 también contribuyen a formar clones de linfocitos B, productores de anticuerpos.
Este proceso, mucho más complejo de lo pergeñado, transcurre mediante la interacción entre distintas estirpes celulares, y por intermediación de sustancias liberadas por unas células inmunitarias que actúan sobre otras, las denominadas genéricamente linfoquinas.
En este intrincado conglomerado de interacciones, los linfocitos T coadyuvantes (designados también como T4) parecen coordinar, si no dirigir, el proceso. La confirmación de su trascendencia quedó evidenciada por la pandemia del SIDA. [El virus, VIH, infecta de preferencia los linfocitos T4 desencadenando un síndrome de inmunodeficiencia].
Para que el linfocito T ejerza su función ha de ser activado. Para ello son precisas dos señales: de un lado, el determinante antigénico ha de ser presentado al linfocito T por una «célula presentadora de antígeno» (macrófagos, células dendríticas o, cualquier célula corporal que exponga en su membrana el fragmento antigénico). Esta señal hace que en la superficie de los linfocitos T4 y T8 se exprese el receptor de una linfoquina, la interleucina-2 (IL2). Esta interleucina activa la formación de clones de células T citotóxicas (T8) y de linfocitos B.
Por otra parte, la interacción de la célula T4 con la «célula presentadora de antígeno» (generalmente un macrófago) desencadena la segunda señal, inespecífica y consistente en la secreción por el macrófago de otra interleucina, la IL1.
Los linfocitos T4 segregan no solo IL2, sino otras linfoquinas (IL4, IL5, IL6) e interferón-γ. Todos estos factores dan lugar a la proliferación y diferenciación de los linfocitos B (secretores de anticuerpos), y de linfocitos T citotóxicos (T8).
MECANISMO DE ACCIÓN DE LA CICLOSPORINA
La ciclosporina tiene como diana farmacológica el linfocito T4 (linfocito T coadyuvante, o T helper). La ciclosporina induce una inmunosupresión, no una inmunodeficiencia como causa el VIH.
¿Cómo lo consigue? Inhibiendo la secreción de interleucina-2 (también de otras linfoquinas) por el linfocito T4 activado por el antígeno.
La ciclosporina actúa en el inicio de la cascada inmunitaria, inhibiendo la secreción de interleucina-2 inmediatamente después de la activación del linfocito T por «células presentadoras de antígeno». Al actuar en este estadio temprano de la reacción inmunitaria, no se producen linfocitos B productores de anticuerpos, ni linfocitos T citotóxicos (T8).
La ciclosporina es activa antes de que se haya desencadenado la respuesta inmunitaria. En el trasplante de órganos se administra, pues, de modo anticipatorio.
En cambio, cuando se prescribe en enfermedades autoinmunes (véase más adelante), la ciclosporina tiende a interrumpir una reacción inmunitaria e inflamatoria ya iniciada.
En cualquier caso, el efecto inmunosupresor de la ciclosporina es selectivo sobre el linfocito T4.
A una escala molecular, la ciclosporina interfiere con una proteína intracelular, la ciclofilina.
La activación del linfocito T por el antígeno activa una vía de señalización intracelular que da lugar a la activación en el núcleo celular de dos factores (proteínas) reguladoras del gen que codifica la síntesis de interleucina-2. Mediante la interferencia con la ciclofilina, la ciclosporina interrumpe esta vía de señalización celular.
Aun cuando la administración de dosis menores de las ensayadas inicialmente redujo la gravedad de los efectos adversos, haciendo posible su uso clínico, la ciclosporina no es un fármaco inocuo. El principal efecto adverso es la toxicidad renal (alteración morfológica de los túbulos renales) que depende de la dosis acumulativa (dosis total administrada) y afecta a entre el 5% y el 10% de los pacientes.
Los linfomas (tumores de los ganglios linfáticos) se deben al virus Epstein-Barr. Es una consecuencia inherente a la propia inmunosupresión. Cualquier actuación farmacológica que induzca un estado de inmunosupresión lleva inextricablemente asociado el riesgo de linfomas. La probabilidad aumenta si se asocia con otros medicamentos inmunosupresores; y aún más si se administra suero antilinfocitario.
El contrapeso entre la eficacia y la toxicidad de la ciclosporina exige la individualización y monitorización de la posología, al objeto de hallar la horquilla terapéutica adecuada, no solo para cada paciente, sino para un mismo paciente bajo circunstancias cambiantes.
Una de las grandes ventajas de la ciclosporina en la prevención del rechazo de durante la cirugía de trasplantes de órganos deriva del «ahorro de esteroides».
CAMBIO DE PARADIGMA EN LA INMUNOSUPRESIÓN
La ciclosporina fue el primer medicamento que actúa de modo específico y selectivo sobre una subpoblación de linfocitos.
Hasta la introducción de la ciclosporina en terapéutica, los protocolos de tratamiento para controlar el rechazo en los trasplantes consistía en la asociación de dosis muy altas de corticosteroides y azatioprina, un medicamento antimitótico no selectivo; y, en ocasiones, un suero antilinfocitario. Estos tratamientos conllevaban una yatrogenia importante, sobre todo para la médula ósea. Al inhibir la médula ósea se desencadena un estado de inmunodeficiencia que deja libre el camino para un sinfín de patógenos oportunistas.
Por esta razón, antes de la década de 1980, el trasplante de órganos (fundamentalmente renales) conllevaba dos riesgos de gravedad pareja: el rechazo y la infección oportunista.
La falta de tratamientos eficaces para la prevención del rechazo frenó la proliferación de los trasplantes renales. Tras un período de euforia inicial, los trasplantes de corazón experimentaron así mismo un parón.
El resurgir de los trasplantes de órganos está directamente vinculado a la comercialización de la ciclosporina.
La ciclosporina ha aportado a un mal necesario, la inmunosupresión, una eficacia notable que ha mejorado sustancialmente la calidad de vida de los pacientes sometidos a trasplante de órganos.
En el trasplante renal el principal problema es la toxicidad renal de la ciclosporina, no totalmente evitable aun cuando se ajuste la posología dentro de un bien diseñado margen terapéutico.
Hasta comienzos de la década de 1980, el principal problema que planteaba el trasplante cardíaco era de tipo médico, no quirúrgico. La reacción de rechazo se manifestaba al cabo de aproximadamente 8 días tras el trasplante, soliendo matar al paciente. La introducción de la ciclosporina en los protocolos de tratamiento, asociado a corticoterapia y azatioprina, ha aumentado el índice de supervivencia de modo significativo.
TRASPLANTES DE MÉDULA
Los trasplantes de médula ósea son técnicamente sencillos (poco más que una transfusión sanguínea), pero muy complejos desde un punto de vista farmacológico. El éxito de la inmunosupresión está condicionado por la compatibilidad tisular definido por el sistema de histocompatibilidad entre donante y receptor. En la actualidad el trasplante de médula ósea se realiza entre personas con receptores HLA idénticos. A pesar de que el rechazo prácticamente ha desaparecido, el paciente queda expuesto a lo que se denomina «reacción de injerto contra huésped». Esta reacción explica casi el 20% de todos los fracasos de los trasplantes de médula ósea. La ciclosporina, asociada a metotrexato, no previene esta reacción, pero reduce su gravedad.
En ausencia de estas complicaciones el tratamiento con ciclosporina tras el trasplante de médula ósea se interrumpe al cabo de varios meses, una vez reconstruida la médula ósea del paciente. He ahí la gran diferencia con los trasplantes de órganos que precisan la inmunosupresión de por vida.
CICLOSPORINA EN LAS ENFERMEDADES AUTOINMUNES
En las enfermedades autoinmunes, el sistema inmunitario reacciona contra tejidos y órganos del propio organismo al no reconocerlos como propios. Esta pérdida de regulación del sistema inmunitario conduce a la producción de linfocitos T autorreactivos y anticuerpos contra moléculas del propio organismo. En este escenario hay un grave proceso de inflamación crónica que termina por destruir el tejido u órgano afectado y, no pocas veces, la muerte del paciente.
La enfermedad y sus manifestaciones clínicas dependen del tejido u órgano contra el que se dirige la reacción de autoinmunidad. Si la diana es la unión de las neuronas motoras con la placa motora de los músculos, la enfermedad es la miastenia gravis; si la reacción se focaliza contra las células de los islotes de Langerhans pancreáticos, se desarrolla diabetes insulina-dependiente; si se trata de las articulaciones, hablamos de artritis reumatoide u osteoartritis; si son anticuerpos antinucleares, nos hallamos ante el lupus eritematoso sistémico; si la reacción autoinmune es contra la vaina de mielina que envuelve los axones neuronales, la enfermedad es la esclerosis múltiple; etc.
Desde el descubrimiento de la ciclosporina se evidenció su poderosa acción contra la inflamación crónica.
Las linfoquinas producidas por los linfocitos estimulan la reacción inflamatoria en el tejido autoagredido. A este ambiente tisular enrarecido acuden con prontitud los macrófagos. La ciclosporina inhibe la síntesis de la interleucina-2 por los linfocitos T4, frenándose todos los procesos inducidos por este factor trópico.
Los ensayos clínicos de la ciclosporina en enfermedades autoinmunes se iniciaron en 1982 sobre cinco patologías de esta clase: uveítis grave, psoriasis, síndrome nefrótico, poliartritis reumatoide y diabetes insulina-dependiente. A estas enfermedades se añadieron otras varias: lupus eritematoso sistémico, enfermedad de Crohn, esclerodermia, anemia aplásica y sarcoidosis.
Otros importantes medicamentos inmunosupresores han enriquecido el armamentaria para la prevención del rechazo tras los trasplantes, y para el control sintomático y la progresión de las enfermedades autoinmunes.
No obstante, la ciclosporina fue, y continúa siendo, un medicamento primordial que permitió el desarrollo de la práctica clínica de los trasplantes de órganos y contribuyó de modo indubitado al control relativo de las enfermedades autoinmunes.
Zaragoza, a 2 de marzo de 2019
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Farmacia Las Fuentes
Florentino Ballesteros, 11-13
50002 Zaragoza

