Se ha desarrollado la tecnología de reprogramación de células T que tiene por objeto eliminar genes defectuosos, sustituyéndolos por sus variantes correctas.
La técnica se está ensayando en diversos laboratorios. Si los resultados son favorables, podría revolucionar el tratamiento del cáncer y de enfermedades autoinmunes (lupus eritematoso, artritis reumatoide, entre otras); así como de algunas enfermedades infecciosas.
Hasta ahora la técnica se ha ensayado en condiciones de laboratorio. Se ha conseguido alterar las células inmunes de niños afectados de graves genopatías. Los genes correctos se vehiculizan mediante virus que los llevan hasta el núcleo celular, insertándose a continuación en el genoma. El procedimiento es complejo y azaroso, pues no siempre los genes se integran en el lugar correcto del genoma.
No obstante, se han conseguido algunos avances. Los pacientes con raros cánceres hematológicos se pueden tratar con células T modificadas genéticamente para atacar a las células tumorales.
La principal limitación de esta tecnología (inmunoterapia) deriva de la dificultad de rediseñar ciertos virus para que actúen como eficientes transportadores de material genético.
La utilización de virus para vehiculizar genes es un procedimiento complejo, siendo precisos varios meses. Una estrategia para acelerar el proceso consiste en usar campos magnéticos que «abran» la célula a los agentes externos, anulando la diferencia de potencial transmembrana. De este modo el tiempo necesario para todo el procedimiento se reduciría desde varios meses a 1 o 2 semanas. Este acortamiento temporal es vital, teniendo en cuenta que la técnica está destinada a cánceres avanzados con limitada perspectiva vital.
El Parker Institute ha encargado a Alexander Marson, director científico de Biomedicina del Innovative Genomic Institute (formado mediante la colaboración de dos universidades californianas, la de San Francisco y la de Berkeley) diseñar células T para el tratamiento de varios tipos de cáncer.
En uno de los estudios del grupo de trabajo de Alexander Marson se diseñaron células T capaces de reconocer células de melanoma humano. Se inyectaron en ratones células malignas de melanoma humano. A continuación se inyectaron células T humanas modificadas genéticamente para que actuasen contra las células del melanoma. Los resultados fueron favorables, ajustándose a lo previsto cuando se diseñó el estudio.
En otro trabajo, se «corrigieron» genéticamente las células T de tres niños con una rara mutación que causaba enfermedades autoinmunes. Se trata de reponer a los niños las células T «corregidas» y observar el alcance de este modo de proceder.
En la actualidad se está valorando la posibilidad de usar esta tecnología para el tratamiento resolutivo de la infección por VIH.
El virus VIH infecta a las células T. Si se lograra rediseñar las células T (más específicamente células T que expresan el marcador CD4, denominándolas por lo tanto TCD4+) para que no pudieran alojar el virus, la infección no progresaría al grave síndrome de inmunodeficiencia (SIDA). Las células TCD4+ que se hubiesen infectado sufrirían lisis, pero el virus no podría infectar las nuevas remesas de células TCD4+ modificadas genéticamente. [Recuérdese que CD es el acrónimo de Cluster of Differentation].
La idea de modificar genéticamente células T sin usar virus no es novedosa, pero hasta ahora los resultados distaban bastante de los esperados.
De sólito, los genes se introducían en las células T usando virus modificados para anular o atenuar su virulencia. Sin embargo, es un proceso azaroso. Los genes no siempre se insertaban en la localización adecuada; y, en no pocas ocasiones, el proceso tenía el peaje de la inhabilitación de otros genes fundamentales.
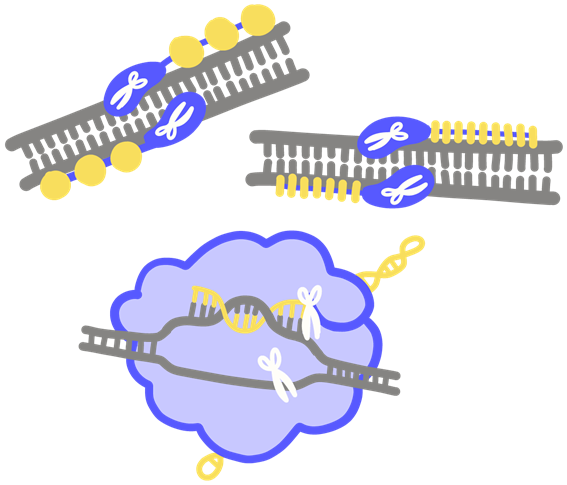 Uno de los objetivos de la investigación es llevar a cabo el proceso de deleción e inserción de genes prescindiendo de los virus u optimizando su utilización. Una idea es una especie de «tijera molecular» (ZFN, TALEN, CRISPR) Se pretende con ello que la inserción de genes sea específica (se produzca solo donde se desea).
Uno de los objetivos de la investigación es llevar a cabo el proceso de deleción e inserción de genes prescindiendo de los virus u optimizando su utilización. Una idea es una especie de «tijera molecular» (ZFN, TALEN, CRISPR) Se pretende con ello que la inserción de genes sea específica (se produzca solo donde se desea).
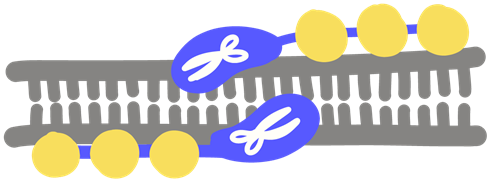 ZFN es el acrónimo de Zinc Finger Nuclease (dibujo superior).
ZFN es el acrónimo de Zinc Finger Nuclease (dibujo superior).
Herramienta de bioingeniería que reconoce secuencias de ADN. La enzima nucleasa (estabilizada con zinc) actúa como un dedo (finger) molecular que separa y corta fragmentos específicos del ADN.
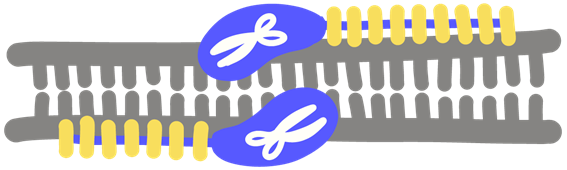 TALENT es el acrónimo de Transcription Activator-Like Effector Nuclease (dibujo superior).
TALENT es el acrónimo de Transcription Activator-Like Effector Nuclease (dibujo superior).
Este instrumento de ingeniería genética está diseñado a base de secuencias que reconocen fragmentos específicos de ADN. Mientras unos dominios se engarzan al ADN, otros cortan el ADN en lugares específicos.
 CRISPR es un tipo de «sistema inmune» primigenio hallado en bacterias y arqueas, usados también como herramienta en ingeniería genética. Es el acrónimo de Clustered Regularly Interspaced Short Palindromic Repeats. Hace referencia a secciones repetitivas del genoma del hospedador que son características del ADN «extraño». Esta herramienta (CRISPR) se usa para detectar y destruir el ADN viral y proteger a las células. [Arqueas son microbios evolutivamente intermedios entre las bacterias – procariotas – y células – eucariotas].
CRISPR es un tipo de «sistema inmune» primigenio hallado en bacterias y arqueas, usados también como herramienta en ingeniería genética. Es el acrónimo de Clustered Regularly Interspaced Short Palindromic Repeats. Hace referencia a secciones repetitivas del genoma del hospedador que son características del ADN «extraño». Esta herramienta (CRISPR) se usa para detectar y destruir el ADN viral y proteger a las células. [Arqueas son microbios evolutivamente intermedios entre las bacterias – procariotas – y células – eucariotas].
Se está ensayando el uso de campos eléctricos que hagan permeables a las células al eliminar la diferencia de potencial transmembrana, asociados a «tijeras moleculares» que abrann la doble hebra de ADN e insertaran el gen específico.
Todas estas estrategias se quieren aplicar tanto a tumores hematológicos como a tumores sólidos.
Zaragoza a 18 de julio de 2018
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Farmacia Las Fuentes
Florentino Ballesteros, 11-13
50002 Zaragoza

