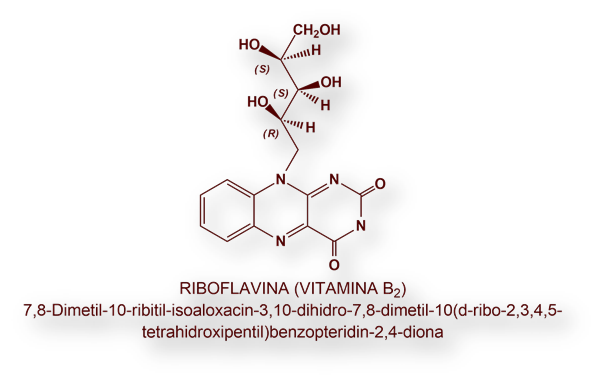
En el año 1919 se creía que solo existían dos vitaminas hidrosolubles: «B» y «C».
Elmer McCollum (universidad de Wisconsin, Estados Unidos) aisló la primera «vitamina liposoluble» en el año 1913. [Hoy día se sabe que existen cuatro vitaminas liposolubles: A, D, E y K].
Durante sus experimentos en ratas Elmer McCollum observó que cuando la lactosa cristalizaba (precipitaba), el sobrenadante tenía la propiedad de corregir una «deficiencia del crecimiento en los animales». Dedujo acertadamente que la fracción acuosa obtenida durante la cristalización de la lactosa (azúcar de leche) contenía un «principio vitamínico» ignorado hasta entonces.
Con anterioridad a su aislamiento, Ejikman y Grijns habían propuesto la existencia de lo que denominaron un «factor anti-neurítico».
La opinión mayoritaria entre los científicos era que el «factor anti-neurítico» descrito (no aislado) por Ejikman y Grijns, y el factor aislado por McCollum eran la misma sustancia. Sin embargo no todos los científicos estaban de acuerdo.
H.H. Mitchell, de la universidad de Illinois publicó un artículo en Journal of Biological Chemistry en el que ponía en duda que se tratase de la misma sustancia. Experimentos posteriores confirmaron que en efecto, se trataban de dos sustancias (vitaminas) diferentes. A partir de entonces comenzó a hablarse de «complejo B», en lugar de «vitamina B» como una sustancia única. (Mitchell H.H. On the identity of the water-soluble growth-promoting vitamin and the anti-neuritic vitamin. J Biol Chem 1919; 40: 399-413).
En el año 1927, el British Committee on Accesory Food Factors, distinguió entre el «factor anti-neurítico» (vitamina B1) ya conocido, y la vitamina recién aislada, menos termolábil que la B1, a la que se designó como B2.
En el Lister Institute, Harriet Chick y M.H. Roscoe desarrollaron en 1928 un ensayo para la determinación de la actividad de la vitamina B2. El ensayo era puramente experimental. Se valoraba el efecto que los preparados de vitamina B2 ejercían sobre las ratas en situación carencial.
La deficiencia de vitamina B2 daba lugar a pérdida del cabello de las cejas, dermatitis, tinción de la orina y retraso del crecimiento. El ensayo era complejo requiriéndose entre 3 y 4 semanas. Se consideró, pues, prioritario el aislamiento de la vitamina B2 en forma pura (cristalizada). En este proyecto participaron Richard Kuhn del Instituto de Química de la universidad de Heidelberg, Theodor Wagner-Jaureg del Instituto Kaiser Wilhelm de Investigación Médica, y el húngaro Paul György. Fruto de estas investigaciones fue la observación de que los extractos que mostraban mayor actividad en el ensayo experimental mostraban una intensa fluorescencia amarillo-verdosa; y que esta fluorescencia estaba directamente relacionada a la potencia del preparado. Todos los intentos de aislar el principio activo del material fluorescente deterioraban los extractos. Estos experimentos sirvieron de base para el ulterior aislamiento de otras vitaminas del «complejo B».
Finalmente, la vitamina B2 se aisló en forma cristalizada en 1933 en la universidad de Heidelberg (Alemania) recibiendo el nombre de Riboflavina, si bien en Estados Unidos perduró durante algún tiempo la denominación, hoy obsoleta, de vitamina G.
Los pigmentos fluorescentes verde-amarillos que recibieron durante algún tiempo epítetos en función de su origen, lactoflavina, ovoflavina, hepatoflavina y verdoflavina, notificados en la leche, huevo, hígado y hierba fresca, respectivamente, eran simplemente Riboflavina.
Tan solo dos años después, en 1935, la Riboflavina se sintetizó por dos grupos de investigación, uno dirigido por Richard Kuhn en la universidad de Heidelberg (Alemania), y el otro por Paul Karrer en la universidad de Zúrich (Confederación Helvética). El procedimiento de síntesis diseñado en Zúrich fue adaptado por el laboratorio Hoffman-La Roche para su producción comercial.
Paul Karrer fue galardonado en el año 1937 con el Premio Nobel de Química ex aequo Norman Haworth por sus trabajos sobre los carbohidratos y la vitamina C. [Entre los méritos del galardón no se mencionaba el logro de la síntesis de la vitamina B2]. Un año más tarde, 1938, el alemán Richard Kuhn, que sintetizó también Riboflavina en Heidelberg, recibió el Premio Nobel por sus trabajos sobre los carotenoides y las vitaminas. Sin embargo, el gobierno del «Partido Obrero Nacional Socialista» (NSDAP, de su acrónimo en alemán) le obligó a rechazar el galardón en su política de no reconocimiento de los premios otorgados por la Fundación Alfred Nobel.
FUENTES DE RIBOFLAVINA
La Riboflavina es ubicua en todos los tejidos animales y vegetales. La leche y los huevos son dos fuentes primordiales de vitamina B2.
En hígado y riñón se halla formando ésteres con ácido fosfórico.
La col y los espárragos tienen elevada concentración de Riboflavina por unidad de materia seca.
La vitamina B2 es lábil en medio alcalino; así como bajo la radiación a partir del azul (azul, violeta y ultravioleta).
SINTOMATOLOGÍA DE LA DEFICIENCIA DE RIBOFLAVINA
La deficiencia de Riboflavina afecta a los tejidos ectodérmicos, piel, ojos y tejido nervioso.
Hay un síndrome característico de su deficiencia observado en los pollos que se expresa al principio con rigidez y curvatura de las patas y, finalmente parálisis. En base a estas características al síndrome se le denomina «parálisis de los dedos torcidos».
En los cerdos con deficiencia de vitamina B2 se producen cataratas debida a pigmentación y angiogénesis de la córnea.
Los rumiantes no tienen requerimientos exógenos, sintetizando la vitamina en el rumen. [El rumen es un saco donde se fermentan microbiológicamente los polisacáridos complejos, pectina, hemicelulosa y celulosa, de los animales herbívoros. Es una característica de los rumiantes].
A diferencia de los herbívoros, los humanos debemos ingerirla de fuentes exógenas, no obstante una limitada síntesis en el microbioma (término genérico para referirse a la flora intestinal).
La deficiencia en el hombre se produce cuando la ingesta es insuficiente. Se desarrolla un síndrome denominado ariboflavonosis, caracterizado por queilosis (lesión degenerativa con aparición de fisuras en labios y boca) estomatitis, glositis, queratitis, dermatitis seborreica, lesiones superficiales en los genitales, anemia normocrómica y normocítica, prurito, y angiogénesis de la córnea. Algunos de estos signos y síntomas son debidos a que la deficiencia de Riboflavina se acompaña del de otras vitaminas como Piridoxina (vitamina B1) o ácido nicotínico, ya que estas vitaminas no pueden llevar a cabo su función metabólica en ausencia de Riboflavina.
Los pacientes con pelagra (deficiencia grave de ácido nicotínico) suelen tener asociada deficiencia de vitamina B2.
REQUERIMIENTOS DE RIBOFLAVINA
La Riboflavina está relacionada con el transporte de energía, de tal suerte que sus requerimientos están directamente relacionados con la ingestión de energía. Un hombre adulto precisa 0,6mg de Riboflavina por cada 1.000 Kcal ingeridas.
Una situación catabólica (pérdida neta de nitrógeno), causada bien por una ingesta muy deficiente o por estrés metabólico da lugar a pérdida urinaria neta de Riboflavina.
RIBOFLAVINA (VITAMINA B2) EN PROCESOS BIOQUÍMICOS
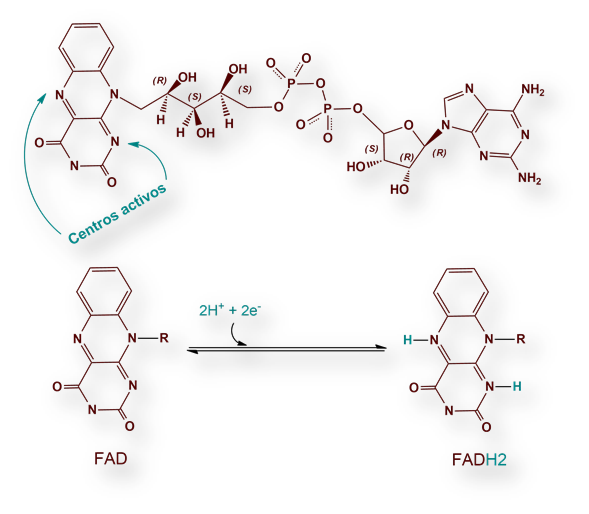
La Riboflavina forma parte de dos flavo-proteínas que actúan como coenzimas. Son el FMN (Flavina-Mono-Nucleótido) y FAD (Flavina-Adenina-Di-nucleótido).
La función bioquímica de estas flavo-proteínas es el transporte de «equivalentes de reducción» (H+).
En los organismos aerobios, el aceptor final de electrones es el O2. Sin embargo, los electrones no se transfieren directamente al O2, sino a través de intermediarios que actúan como transportadores. Estas moléculas transportadoras son derivados de vitaminas: NADH, forma reducida de Nicotinamida Adenina Dinucleótido (NAD+), y FADH2 (forma reducida de la Flavina-Adenina-Dinucleótido, abreviadamente FAD). NADH y FADH2 transfieren electrones de «alto potencial» a la molécula de oxígeno O2.
El principal aceptor de electrones en los procesos metabólicos de oxidación es la forma oxidada de la Nicotinamida Adenina Di-nucleótido (NAD+).
El otro transportador de electrones en la oxidación de combustibles moleculares es el coenzima Flavina-Adenina-Di-nucleótido (FAD).
La reacción se esquematiza: FAD ® FADH2.
La parte reactiva del FAD es el anillo de isoaloxacina, derivado de la vitamina B2 (Riboflavina). A diferencia del NAD+ (ver informe sobre vitamina ácido nicotínico), FAD acepta dos protones:
 REACCIONES EN QUE FAD ACTÚA COMO COENZIMA
REACCIONES EN QUE FAD ACTÚA COMO COENZIMA
- Cofactor de la enzima piruvato-deshidrogenasa.
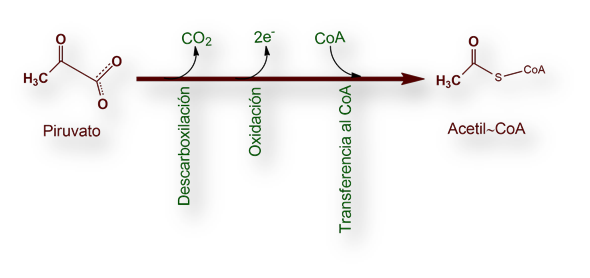
Piruvato + CoA + NAD+ ® acetil~CoA + CO2 + NADH
El mecanismo de esta reacción es mucho más complejo de lo que cabría prever a partir de su estequiometria, relativamente simple.
La reacción precisa de la intervención de tres enzimas del complejo piruvato deshidrogenasa, cada una formada a su vez por varias cadenas de polipéptidos, tres cofactores catalíticos (TPP, ácido lipóico y FAD), y dos cofactores estequiométricos (CoA y NAD+).
 La actividad del complejo piruvato deshidrogenasa se regula por dos enzimas adicionales.
La actividad del complejo piruvato deshidrogenasa se regula por dos enzimas adicionales.
La conversión de piruvato en acetil~CoA transcurre en tres etapas: descarboxilación, oxidación y transferencia del grupo acilo resultante al CoA. Esquemáticamente:
El proceso metabólico transcurre de la siguiente manera:
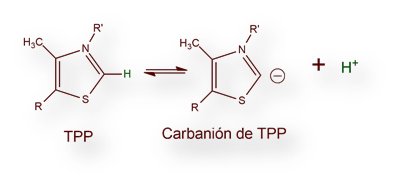
El piruvato se combina con tiamina-pirofosfato (TPP) y se descarboxila, reacción catalizada por la enzima E1 del complejo «multi-enzimático piruvato-deshidrogenasa». Obsérvese que el átomo de carbono se sitúa entre los átomos de nitrógeno y azufre del heterociclo de tiazol. Este átomo de C es bastante ácido (pKa ≈ 10). Se forma, pues, el carbanión que reacciona rápidamente con el grupo carbonilo del piruvato.
- Cofactor en la síntesis de esfingosina
Los esfingolípidos son ubicuos en la membrana plasmática de todas las células eucariotas, con predominio en las células del sistema nervioso central. La viga maestra de un esfingolípido es la estructura de esfingosina, de igual manera que los fosfolípidos se construyen a partir de un armazón químico de glicerol.
El palmitil~CoA y el aminoácido serina se condensan para formar deshidroesfingosina. Esta se deshidrogena hasta esfingosina. Esta última reacción está catalizada por una enzima deshidrogenasa, en la que FAD actúa como cofactor.
 Los electrones del NADPH (nicotinamida-adenina-di-nucleótido-fosfato reducido) no se transfieren directamente al enlace sulfuro del glutatión oxidado (GSSG), sino por intermediación del FAD (flavina-adenina-dinucleótido). Esta transferencia transcurre en el entorno de una enzima con actividad reductasa.
Los electrones del NADPH (nicotinamida-adenina-di-nucleótido-fosfato reducido) no se transfieren directamente al enlace sulfuro del glutatión oxidado (GSSG), sino por intermediación del FAD (flavina-adenina-dinucleótido). Esta transferencia transcurre en el entorno de una enzima con actividad reductasa.
El glutatión reducido (GSH) es esencial para mantener la estructura del hematíe y conservar el grupo prostético hemo de la hemoglobina en su estado ferroso (F22+) de oxidación.
La forma reducida del glutatión (GSH) es esencial en los procesos de destoxificación del peróxido de hidrógeno y otros peróxidos orgánicos (ROOH), según la siguiente reacción:
2 GSH + ROOH ® GSSG + H2O + ROH
Las células con bajos niveles de glutatión reducido (GSH) son mucho más susceptibles a la hemólisis. ¿Por qué? El glutatión reducido actúa como reductor químico de peróxidos orgánicos (ROOH), subproductos del metabolismo muy dañinos para la estructura de las membranas celulares y sub-celulares, y de otras moléculas. La enzima que cataliza estas reacciones de destoxificación es la «glutatión peroxidasa». Además, en ausencia del enzima, los grupos sulfhidrilo [-SH] (mercapto) de la hemoglobina no pueden permanecer en forma reducida, formándose agregados de hemoglobina, conocidos como «corpúsculos de Heinz» (tal como fueron caracterizados por observación microscópica por primera vez en 1880). Estos agregados deforman el hematíe que termina experimentando hemólisis. [A veces se les denomina «cuerpos de Heinz-Erlich»].
SÍNTESIS DEL FAD (FLAVINA-ADENINA-DINUCLEÓTIDO)
Flavina-adenina-dinucleótido (FAD) se sintetiza a partir de Riboflavina (vitamina B2) y dos moléculas de ATP. El ATP (la moneda energética de las células) fosforila a la Riboflavina, produciéndose Riboflavina-5’-monofosfato (FMN, de Flavina Mono-Nucleótido).
El FAD se genera por adición de una adenosina a partir de otra molécula de ATP, liberándose un pirofosfato (PPi).
Esquemáticamente:
Riboflavina + ATP ® Riboflavina-5’-fosfato + ADP
Riboflavina-5’-fosfato + ATP ® Flavina-adenina-dinucleótido + PPi
Una característica común a la biosíntesis de NAD+. FAD y Coenzima-A es la transferencia de una unidad de AMP (adenosina-mono-fosfato) al grupo fosfato de un intermediario fosforilado (FMN, en el caso del FAD). La energía termodinámica para que las reacciones transcurran en el sentido indicado procede de la hidrólisis del pirofosfato que se genera hasta dos unidades de ortofosfato.
Zaragoza a 28 de octubre de 2017
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Farmacia Las Fuentes
Zaragoza