Kimishige Ishizaka, inmunólogo japonés que realizó trascendentes hallazgos en el área de la alergia, falleció el 6 de julio (2018) en Yamagata, Japón, a los 92 años de edad. Su óbito fue comunicado por La Jolla Institute for Allergy and Immunology, en California, Estados Unidos. Durante varios años Kimishige Ishizaka presidió y dirigió dicha institución.
Junto a su esposa, Teruko Ishizaka, también prestigiosa inmunóloga, llevaron a cabo durante la década de 1960 trascendentes descubrimientos que hicieron factible los tratamientos de enfermedades como el asma, la entonces denominada «fiebre del heno» (rinitis alérgica), y las alergias a alimentos y medicamentos.
En sus trabajos insistía en que el incremento de los procesos alérgicos en la infancia se debe a que los niños en las sociedades desarrolladas (hiperhigiénicas) tienen una insuficiente exposición a los alérgenos.
Durante décadas, los investigadores han estudiado la reagina, un anticuerpo involucrado en las reacciones alérgicas, designado hoy día como IgE.
Las IgE en sangre son monómeros de 190 quilodalton [1 dalton equivale a 1 «unidad de masa atómica»]. Las IgE tienen las concentraciones más bajas de todos los isotipos. La Vida Media de las IgEs en sangre periférica varía de 1 a 5 días, aproximadamente. Las concentraciones de IgE son mínimas al nacer, incrementándose hasta un máximo alrededor de los 15 años de edad, iniciando una disminución lenta y progresiva el resto de la vida, excepto si se producen infecciones parasitarias por gusanos.
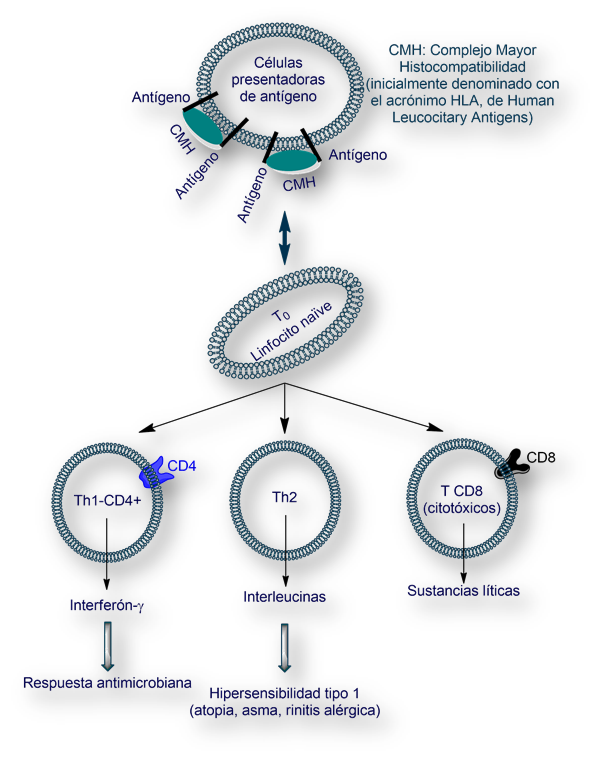
 Cuando se produce una infección por helmintos, los antígenos son expuestos por «células presentadoras de antígeno» que estimulan a los linfocitos Th2 (linfocitos T helper tipo 2). Éstos segregan citoquinas (principalmente interleucinas 3 y 13, abreviadamente, IL3 e IL13), que modifican la memoria de las células B haciendo que sinteticen y segreguen IgE (reagina).Las IgEs segregadas tapizan la superficie del helminto atrayendo a los eosinófilos, las únicas células competentes frente a estos parásitos.
Cuando se produce una infección por helmintos, los antígenos son expuestos por «células presentadoras de antígeno» que estimulan a los linfocitos Th2 (linfocitos T helper tipo 2). Éstos segregan citoquinas (principalmente interleucinas 3 y 13, abreviadamente, IL3 e IL13), que modifican la memoria de las células B haciendo que sinteticen y segreguen IgE (reagina).Las IgEs segregadas tapizan la superficie del helminto atrayendo a los eosinófilos, las únicas células competentes frente a estos parásitos.
[Las «células presentadoras de antígenos» designan a diversas estirpes celulares del sistema inmunitario (células dendríticas de la piel, macrófagos, timocitos, células endoteliales, y otras, que engullen moléculas foráneas desmenuzándolas y exponiendo sobre su superficie moléculas de menor tamaño (antígenos) que, tras la interacción con linfocitos B naïve (no diferenciados), dan lugar a la formación de un clon productor de anticuerpos específicos].
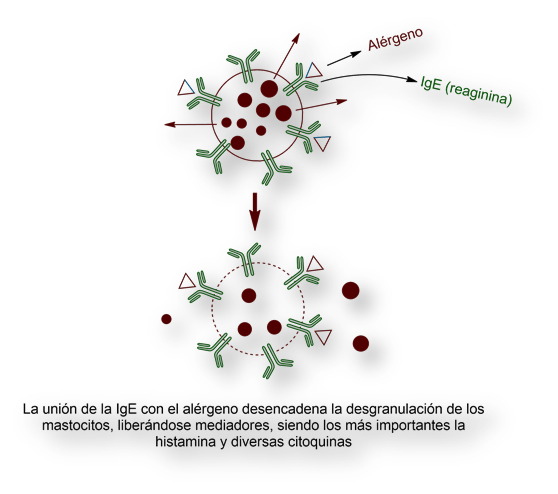 Las IgEs también están relacionadas con el asma, la rinitis alérgica (antiguamente denominada «fiebre del heno») y las reacciones anafilácticas, procesos englobados bajo el epíteto de «hipersensibilidad inmediata». Las células involucradas en las reacciones de «hipersensibilidad inmediata», los mastocitos expresan en su superficie las IgEs que, tras su unión con el alérgeno, liberan sus depósitos intracelulares de histamina y otros mediadores químicos, responsables de los síntomas característicos de la alergia (tos, estornudos, rinitis, conjuntivitis, dermatitis).
Las IgEs también están relacionadas con el asma, la rinitis alérgica (antiguamente denominada «fiebre del heno») y las reacciones anafilácticas, procesos englobados bajo el epíteto de «hipersensibilidad inmediata». Las células involucradas en las reacciones de «hipersensibilidad inmediata», los mastocitos expresan en su superficie las IgEs que, tras su unión con el alérgeno, liberan sus depósitos intracelulares de histamina y otros mediadores químicos, responsables de los síntomas característicos de la alergia (tos, estornudos, rinitis, conjuntivitis, dermatitis).
Las IgE no atraviesan la placenta; y no fijan el complemento, por lo que no actúan como opsoninas («factores moleculares» que facilitan la fagocitosis por los macrófagos). [Complemento es un término genérico que designa a un conjunto de «factores proteicos» que fortalecen la unión «antígeno—anticuerpo» La presencia del complemento en la unión «antígeno—anticuerpo» es imprescindible para la lisis, aglutinación y opsonización de las células foráneas, requisitos para el proceso de fagocitosis.].
LA HIGIENE, FACTOR PREDISPONENTE A ALERGIA Y ATOPÍA.
Las áreas urbanas de los países desarrollados tienen los índices más elevados de «hipersensibilidad tipo 1». Por el contrario, los países con sistemas sanitarios más precarios muestran tasas muy bajas de atopía.
 La placenta segrega citoquinas derivadas de los linfocitos Th2 con objeto de mantener la tolerancia al feto (evitar el rechazo del feto por la madre gestante). De este modo, en la sangre del cordón umbilical existe una clara preponderancia de linfocitos Th2. Tras el nacimiento, las infecciones modifican el balance «Th1 vs Th2» a favor de los linfocitos Th1. Si existe una excesiva protección del recién nacido frente a las infecciones (vacunación, terapia antibiótica, higiene exagerada) el balance continúa siendo favorable a los linfocitos Th2.
La placenta segrega citoquinas derivadas de los linfocitos Th2 con objeto de mantener la tolerancia al feto (evitar el rechazo del feto por la madre gestante). De este modo, en la sangre del cordón umbilical existe una clara preponderancia de linfocitos Th2. Tras el nacimiento, las infecciones modifican el balance «Th1 vs Th2» a favor de los linfocitos Th1. Si existe una excesiva protección del recién nacido frente a las infecciones (vacunación, terapia antibiótica, higiene exagerada) el balance continúa siendo favorable a los linfocitos Th2.
Por ejemplo, en Europa y Norteamérica, antes de la generalización de las prácticas higiénicas, la hepatitis A afectaba al 30% aproximadamente de la población. Cuando este porcentaje se redujo por la mejora de la salud pública, se observó un incremento parejo de los cuadros de atopia, rinitis alérgica y asma.
Tras la caída del Muro de Berlín (noviembre de 1989) la incidencia de las reacciones de «hipersensibilidad tipo 1» entre los ciudadanos de la antigua República Democrática de Alemania aumentó significativamente, tras la reunificación debido a la mejora de los programas de salud.
Simplificando en extremo se puede afirmar que la preponderancia de linfocitos Th2 predispone a reacciones de «hipersensibilidad tipo 1» (asma, atopía, rinitis alérgica), mientras que los linfocitos Th1 son predominantes durante los procesos infecciosos y las enfermedades autoinmunes.
La denominada «teoría de la higiene» no es aceptada de modo general. Una de las razones esgrimidas es que las enfermedades autoinmunes, en las que existe un predominio de linfocitos Th1, son más frecuentes en sociedades desarrolladas.
Los linfocitos T son la principal fuente de citoquinas (mensajeros químicos de la inmunidad). Desde un punto de vista funcional, las citoquinas se pueden clasificar en dos grupos: las «pro-inflamatorias puras»; y las «pro-inflamatorias que también promocionan respuestas alérgicas».
Los linfocitos Th1 segregan citoquinas «pro-inflamatorias», siendo la principal interferón-γ. Esta estirpe de linfocitos están involucrados en la lucha contra parásitos intracelulares, y en las reacciones autoinmunes. Una excesiva reacción de los linfocitos Th1 puede dañar los tejidos. Existe un mecanismo de control que limita la reacción desencadenada por los linfocitos Th1. Este mecanismo se organiza con los linfocitos Th2 (que segregan diversas interleucinas, e IgEs). Un exceso de actividad Th2 limita la respuesta antimicrobiana de los Th1. Así pues, un elegante balance del cociente «Th1 vs Th2» es fundamental para una respuesta inmunitaria adecuada.
Los linfocitos T naïve (designados como T0) se diferencian en diversas estirpes celulares en función de los receptores de membrana, fundamentalmente CD4 y CD8. Los linfocitos TCD4+ (expresan en su membrana el receptor CD4) se denominan Th (h, de coadyuvante, helper en inglés); divididos a su vez en dos estirpes Th1 y Th2.
Durante su etapa como responsable de inmunología del Children’s Asthma Research Institute and Hospital (hoy día, Jewish Health), en Denver, Colorado, Estados Unidos, Kimishige Ishizaka llevó a cabo experimentos en los que él mismo, su esposa y varios colegas se ofrecieron para recibir inyecciones de sustancias (alérgenos) al objeto de estudiar los anticuerpos que se sintetizasen contra estas sustancias. De esta manera identificó y definió por primera vez la inmunoglobulina E (abreviadamente IgE), también denominada reagina.
Kimishige Izhizaka no solo identificó el anticuerpo responsable de las reacciones alérgicas (IgE), sino que descifró cómo funciona: se establece una unión entre el anticuerpo, el alérgeno y el mastocito, un tipo de glóbulos blancos. [Mastocito deriva del alemán mast, cebado. Bajo el microscopio, estos glóbulos blancos se presentan como si estuviesen cebadas].
Una vez que anticuerpo, alérgeno y mastocito se hallan asociados, el mastocito segrega histamina y otras citoquinas, que desencadenan la sintomatología clásica de la reacción alérgica (espasmos bronquiales, rinitis, conjuntivitis, estornudos, dermatitis).
Una excesiva síntesis de IgE da lugar a la liberación de histamina en cantidad suficiente para desencadenar una dilatación capilar extensa.
Estos hallazgos, que hoy nos parecen sencillos, fueron trascendentes cuando se publicaron en 1966 para comprender los mecanismos de las reacciones alérgicas.
Tres años después, con la colaboración de Kimishige Ishizaka, el grupo de investigación dirigido por S.G.O. Johansson y Hans Bennich, en Upsala, Suecia, publicaron hallazgos similares.
A partir de 1970, durante casi dos décadas, el matrimonio Ishizaka llevó a cabo investigaciones en el John Hopkins University, donde Kimishige era profesor de biología, medicina y microbiología.
En 1989 fue nombrado director científico de la entonces La Jolla Institute for Allergy and Immunology (hoy, Jewish Health).Dos años después asumió también el puesto de presidente de la institución.
En el año 1996, se retiró, asentándose en Yamagata, en el norte de Japón, hogar de su esposa.
Ishizaka Kimishige había nacido un 3 de diciembre de 1925 en Tokio.
Realizó sus estudios de medicina (1948) y el posterior doctorado en Tokio. En 1949 contrajo matrimonio, con su colega de profesión Teruko Matsuura (nombre de soltera).
Entre los años 1953 y 1962, Kimishige Ishizada encabezó la sección de Inmunoserología en el Instituto Nacional de Salud Pública japonés. Se trasladó al California Institute of Technology (más conocido como CalTech) en el año 1962. El matrimonio inició sus investigaciones en el Centro de Investigación de Denver, Colorado, Estados Unidos.
En el bienio 1984-5 fue el primer científico no nacido en Estados Unidos que llegó a presidir la American Association of Immunologists.
En el año 2000 recibió el premio de la Fundación de Ciencia y Tecnología de Japón.
Zaragoza, a 14 de agosto de 2018
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Farmacia Las Fuentes
Florentino Ballesteros, 11-13
50002 Zaragoza

