El lupus eritematoso se identificó como entidad nosológica independiente a mediados del siglo XIX, si bien como una enfermedad autolimitada a la piel.
En los años finiseculares, Moritz Kaposi, en Viena, y William Osler, en la Universidad John Hopkins, dieron cuenta de un amplio número de manifestaciones clínicas asociadas generalmente al entonces denominado “lupus facial”. Éstas eran: artritis, neumonía y otros síntomas del sistema nervioso central. Con el transcurso de los años, se iban añadían al cuadro clínico afectaciones de otros órganos. Sin embargo, la enfermedad, claramente sistémica, recibió su denominación actual, lupus eritematoso sistémico, en el año 1941, siguiendo las investigaciones realizadas por Paul Klemperer, Abou D. Pollack y George Baehr, a la sazón en el Hospital Mount Sinai, de New York. La describieron como un enfermedad sistémica que afectaba tanto al colágeno (tejido conjuntivo o conectivo) como a la vascularización (enfermedad “colágeno-vascular” se decía entonces).
Fue preciso esperar a finales de la década de 1940 para descifrar el componente inmunológico del lupus eritematoso sistémico. Tras años de estudios histológicos, en el año 1948 M. M. Hargraves, adscrito entonces a la Clínica Mayo, descubrió la «célula del lupus eritematoso» (ver imagen).
Halsted R. Holman y Henry Kunkel demostraron que el suero de pacientes con lupus eritematoso contenía una gammaglobulina que reaccionaba con las proteínas (histonas) que se asocian al ADN. [El ADN, una molécula muy nucleofílica, tiene una importante carga negativa neta. Se asocia con proteínas (histonas) con carga positiva neta para otorgar estabilidad al complejo, la cromatina. De hecho, durante la década de 1940 se seguía creyendo que la herencia se sustentaba en estas proteínas nucleares, y no tanto en la relativamente modesta molécula del ADN]. La observación de que el suero de los pacientes estudiados con lupus eritematoso sistémico contenía anticuerpos con el complejo nuclear «ADN↔histona» hizo pensar que se trataba de una enfermedad autoinmune.
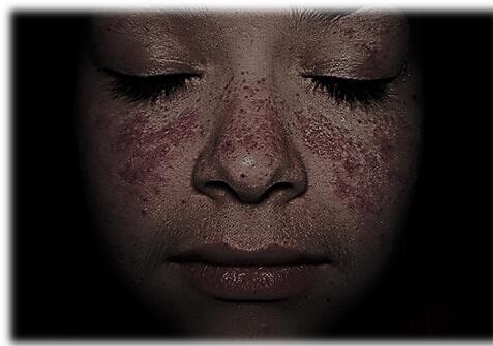
Una de las primeras manifestaciones del lupus eritematoso sistémico es una erupción en forma de mariposa que cubre la nariz y mejillas (ver imagen retocada al inicio del artículo). El nombre de la enfermedad (lupus eritematoso) significa “lobo rojo”, debido a que esta erupción remeda el aspecto de la cara de un lobezno. Sin embargo, este signo patognomónico esconde la naturaleza reumática poli-sistémica de la enfermedad. La prevalencia en las mujeres es un orden de magnitud (10 veces) mayor que en los hombres. Afecta a órganos tan diversos como corazón (pericarditis), pulmones (pleuresía), sistema nervioso central, articulaciones, vasos sanguíneos y riñones. De hecho, la afectación renal (glomerulonefritis) es uno de los aspectos más graves del cuadro clínico.
El lupus eritematoso sistémico pasó a considerarse una enfermedad autoinmune. Esta visión se ha modificado recientemente. Hoy día se tiene el convencimiento de que el lupus eritematoso sistémico se produce por las lesiones tisulares derivadas de la formación de complejos «antígeno ↔ anticuerpo», siendo algunos antígenos, pero no todos, provenientes del propio paciente.
Las enfermedades autoinmunes surgen de un fallo del sistema inmunitario a la hora de distinguir lo propio de lo extraño, lo que el fisiólogo prusiano Paul Ehrlich denominaba «horror autotoxicus».
Tanto los auto-anticuerpos como los «complejos inmunitarios» son ubicuos en el suero de los mamíferos. Según un modelo teórico desarrollado años ha por Niels Kaj Jerne, del Instituto Inmunológico de Basel, Suiza, un determinado tipo de auto-anticuerpos (anticuerpos anti-idiotipo) representan uno de los sistemas de regulación del sistema inmunitario. Son anticuerpos que se engarzan a determinante antigénicos (idiotipos[1]) que se hallan próximos al sitio de unión con la IgG. Estos anticuerpos anti-idiotipo modifican la respuesta inmunitaria, incrementándola o anulándola.
Entre los auto-anticuerpos más comunes en el hombre se cuentan los factores reumatoides, dirigidos contra las gammaglobulinas[2]. Estos auto-anticuerpos tienen altos títulos en pacientes con enfermedades reumáticas y en aquellos con lupus eritematoso sistémico. Los auto-anticuerpos, con títulos bajos en personas sin patología alguna, se cree que desempeñan alguna trascendente función en la homeostasis. La sintomatología clínica asociada al lupus eritematoso sistémico parece ser consecuencia de elevados títulos de auto-anticuerpos.
Las manifestaciones clínicas y la anatomía patológica del lupus eritematoso sistémico semejan mucho más la enfermedad del suero[3] que las típicas enfermedades auto-inmunitarias.
Afirmar que el lupus eritematoso sistémico está ligado a la formación de complejos inmunitarios no hace posible identificar la causa, o causas, que la producen. Se desconoce porqué se desencadena. Se sabe que existe predisposición genética; otros posibles factores desencadenantes del lupus eritematoso sistémico incluyen los estrógenos (endógenos y exógenos), radiaciones ultravioleta e infecciones víricas (¿?).
La sospecha de que la radiación ultravioleta sea un factor desencadenante surgió tras la observación de la especial sensibilidad a la exposición solar de los pacientes con lupus eritematoso sistémico. Las lesiones cutáneas suelen aparecer en las áreas más expuestas al sol. Todavía más: las lesiones del lupus en órganos internos (riñón, corazón, pulmón) se agravan tras la exposición solar.
El involucramiento de los virus en la etiología del lupus eritematoso sistémico es controvertido: la infección vírica, bien podría ser el factor desencadenante o una consecuencia del tratamiento inmunosupresor que se instaura en los pacientes.
La implicación de los estrógenos tiene un nivel de evidencia más claro: el lupus eritematoso sistémico se da de preferencia en mujeres durante su edad reproductora cuando el nivel de estrógenos es máximo; los anticonceptivos orales estrogénicos exacerban la enfermedad. Por otra parte, los hombres muy raramente padecen la enfermedad. De hecho, se observa con mayor frecuencia en varones con el Síndrome de Klinefelter, una genopatía en que los varones presentan dos cromosomas X y el cromosoma Y.
El lupus eritematoso sistémico es una enfermedad cíclica, en que se alternan fases de reagudización con otras de remisión, si bien el daño sobre los órganos afectados (sobre todo en riñón y corazón) es progresivo e irreversible. El tratamiento inmunosupresor, a pesar de su notable yatrogenia, ha aumentado de modo muy significativo la supervivencia a medio plazo: si a comienzos del siglo XX la supervivencia a los cinco años era de aproximadamente el 50%, hoy día supera el 90%.
El tratamiento continúa siendo empírico, a base de anti-inflamatorios no-esteroideos, corticosteroides, Cloroquina y otros inmunosupresores.
NOVEDADES FARMACOLÓGICAS MÁS RECIENTES
Rituximab, un anticuerpo monoclonal quimérico (humano-murino) dirigido contra el antígeno CD[4]-20 que se expresa sobre la membrana de los linfocitos B, pero no en las células plasmáticas derivadas de aquellos. [Rituximab se prescribe en el tratamiento del linfoma]. La administración de Rituximab (infusión intravenosa) se suele reservar para aquellos pacientes refractarios al micofenolato de mofetilo.
La administración intravenosa de inmunoglobulinas, a pesar de carecer de evidencia científica, representa otra estrategia terapéutica cuando no es factible la prescripción de inmunosupresores.
En la actualidad se están llevando a cabo ensayos clínicos con potenciales fármacos tales como Abatacept y Epratuzumab. [Abatacept es una proteína de fusión que previene la activación de las células T, muy abundantes en la sinovia de pacientes con artritis reumatoide. Se encuadra en el grupo de fármacos «modificadores del curso de la enfermedad»]. [Epratuzumab es un anticuerpo monoclonal contra el antígeno CD-22, usado, bien en monoterapia o asociado a Ytrio90 para el tratamiento del linfoma no-Hodgkin].
El lupus eritematoso sistémico es el resultado de una alteración en el exquisito y elegante equilibrio inmunológico, en el que múltiples actores, principales unos (linfocitos B, células T, proteínas del complemento, anticuerpos), secundarios otros han de trabajar en perfecta coordinación.
[1] Es importante la diferencia entre idiotipo, isotipo, alotipo y epítopo.
Epítopo (determinante antigénico) es una parte de la molécula de antígeno capaz de desencadenar la síntesis de un anticuerpo.
Idiotipo: parte la molécula de antígeno que se sitúa muy próxima al determinante antígeno o epítopo.
Isotipo: Característica de los anticuerpos que hace posible su clasificación en los cinco tipos característicos: IgA, IgD, IgG, IgM e IgE. Su formación transcurre durante el proceso de maduración de los linfocitos B hasta células plasmáticas.
Alotipos: tipos de anticuerpos que se distinguen por mínimas diferencias en la secuencia de aminoácidos en las cadenas ligeras y pesadas de las inmunoglobulinas.
[2] Gammaglobulinas se diferencian de otras globulinas, albúmina entre ellas, por sus características electroforéticas.
[3] Enfermedad del suero: reacción inmunitaria en personas tratadas con un antisuero preparado en caballos para contrarrestar los efectos de la toxina tetánica. Von Pirquet sugirió que la reacción se debía a la interacción de los anticuerpos del paciente con antígenos extraños (proteínas del suero de caballo). Se formaba un complejo inmunitario «antígeno ↔ anticuerpo» responsable de los efectos articulares y dermatológicos.
[4] CD, acrónimo en inglés de Cluster of Diferentation.
Zaragoza, 2 de julio de 2016
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
FARMACIA LAS FUENTES
ZARAGOZA