La enfermedad cardiovascular, en sus distintas manifestaciones, es una de las patologías con mayor morbilidad y mortalidad, tanto en países industrializados como en los denominados eufemísticamente países en vías de desarrollo.
Un desencadenante común en los infartos de miocardio y en los accidentes cerebrovasculares (ictus) es el engrosamiento de las paredes arteriales (arterioesclerosis) que reduce la luz de las arterias hasta el punto de obliterarse cuando se interpone un coágulo (trombo).
Los estudios fisiológicos han desentrañado hasta el detalle el mecanismo mediante el que se forman los coágulos (coagulación), y que subyace en las trombosis y embolias. Su conocimiento ha pergeñado las posibles estrategias para la intervención farmacológica. Una de estas líneas de investigación condujo a la síntesis de la Ticlopidina en el año 1972.
La arterioesclerosis es un proceso lento, insidioso y asintomático, consistente en el engrosamiento de las capas media e interna de las paredes de arterias de mediano o gran calibre. La primera consecuencia es la formación de placas de ateroma que reducen el calibre de las arterias a la vez que las vuelven rígidas. Existen factores favorecedores de este proceso: algunos, como la edad, son fisiológicos y, por lo tanto, inevitables; otros son modificables (corregibles), tales como la disminución a concentraciones del colesterol y los triglicéridos en plasma, el control de la tensión arterial y la evitación del tabaquismo (la nicotina desencadena vasoconstricción en las arterias de resistencia de miembros inferiores).
La placa de ateroma no es estable, sino que se fractura con relativa facilidad, liberando fragmentos al torrente circulatorio. Además, el deterioro sufrido por la capa celular interna de las arterias desencadena mecanismos fisiológicos de reparación consistentes en la adhesión de plaquetas y el depósito de la proteína fibrina, formándose un trombo. Este mecanismo, muy eficaz cuando sufrimos una lesión externa, frena la hemorragia. Sin embargo, cuando se produce en el interior de las arterias, el resultado es la obstrucción (obliteración) del vaso sanguíneo. Las consecuencias de tal obliteración dependerán del área que deje de estar irrigada, más allá del trombo. La falta de irrigación (y de consiguiente oxigenación) del tejido puede derivar en situaciones muy variadas, desde un infarto de miocardio a un accidente isquémico transitorio o grave.
Si trombo desprendido de la placa de ateroma viaja hasta taponar una arteria pulmonar o cerebral se produce una embolia. Este tipo de accidentes cardiovasculares dan lugar a una elevada morbilidad y mortalidad.
El abordaje terapéutico de este proceso multifactorial es necesariamente multifarmacológico.
Las primeras fases del tratamiento van dirigidas al control de la trigliceridemia, hipercolesterolemia e hipertensión.
La segunda etapa es el tratamiento antitrombótico.
Los coágulos sanguíneos son, sobre todo, agregados de plaquetas.
En el año 1963 (Born G.V.R. Cross M.J. J Physiol 1963; 168: 178) se desarrolló una técnica para estimar la agregación plaquetaria. Ello, entre otras cosas, hizo posible demostrar la importancia de la agregación de las plaquetas en el proceso de coagulación sanguínea.
Cuatro años más tarde (1967) (Weis H.J. Aledort L.M. The Lancet 1967; 2: 495) se demostró in vitro la acción antiagregante de la Aspirina® En esa misma época un estudio retrospectivo evidenció una menor incidencia de infartos de miocardio entre los reumáticos (en aquellos años tratados con Aspirina®). No obstante, esta observación no constituye una credencial para avalar la acción antiagregante de la Aspirina®. Estos hallazgos fueron determinantes para la investigación de posibles medicamentos antiagregantes plaquetarios, como alternativa a los anticoagulantes de manejo más complejo y de resultados, en aquella época, relativamente decepcionantes.
 El grupo de investigación de Castaigne (más tarde integrado en Sanofi, hoy día Sanofi-Aventis) llevó a cabo un screening farmacológico de un sinfín de moléculas derivadas de la piridina con potencial antiagregante plaquetario. Una de las más prometedoras fue la Ticlopidina, sintetizada en el año 1972 (Maffrand J.P. Eloy F. Eur J Med Chem 1974; 9: 483). En aquella época la eficacia antiagregante plaquetaria se estudiaba ex vivo, y no in vitro (en los que la Ticlopidina se muestra poco activa).
El grupo de investigación de Castaigne (más tarde integrado en Sanofi, hoy día Sanofi-Aventis) llevó a cabo un screening farmacológico de un sinfín de moléculas derivadas de la piridina con potencial antiagregante plaquetario. Una de las más prometedoras fue la Ticlopidina, sintetizada en el año 1972 (Maffrand J.P. Eloy F. Eur J Med Chem 1974; 9: 483). En aquella época la eficacia antiagregante plaquetaria se estudiaba ex vivo, y no in vitro (en los que la Ticlopidina se muestra poco activa).
El hecho de que la Ticlopidina solo se evidenciase activa en el test de Born, pero en ninguno de otros cuarenta que formaban parte de la batería de estudios de eficacia antiagregante, lejos de hacer dudar de su verdadera eficacia se consideró acertadamente que era consecuencia de una gran especificidad de acción (Podesta M., et al. Eur J Med Chem 1974; 9: 487).
El distinto mecanismo de acción de la Ticlopidina en relación al de la Aspirina® (que se comenzaba a prescribir como antiagregante aun cuando no se habían realizado estudios que avalasen dicha indicación) fue un importante estímulo en esta línea de investigación.
Formación del coágulo in vivo.
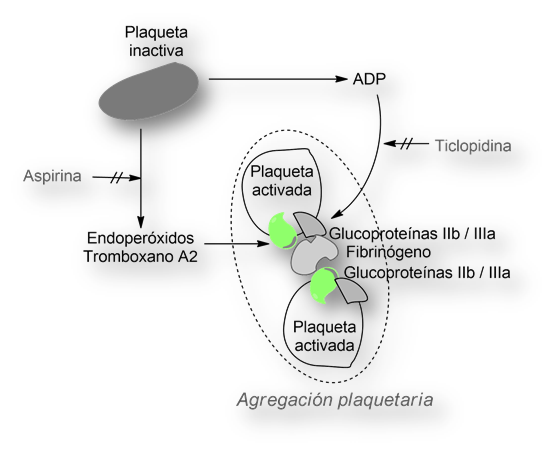 La formación del coágulo in vivo se desencadena tras cualquier lesión. En el proceso se involucran plaquetas, diversas sustancias plasmáticas y otras segregadas por las células del endotelio vascular.
La formación del coágulo in vivo se desencadena tras cualquier lesión. En el proceso se involucran plaquetas, diversas sustancias plasmáticas y otras segregadas por las células del endotelio vascular.
Una serie de moléculas endógenas (endoperóxidos, tromboxano A2, ADP – adenosildifosfato) actúan como activadoras de las plaquetas. Éstas segregan glucoproteínas IIb y IIIa (GPIIb/IIIa). El ADP, tras unirse a su receptor específico en la superficie de las plaquetas, modifica la conformación de las glucoproteínas IIb y IIIa. El complejo (GPIIb/IIIa ↔ ADP) actúa como receptor de una proteína circulante, el fibrinógeno. El fibrinógeno a modo de cemento entre las plaquetas formándose un agregado. Este es el mecanismo último de la agregación plaquetaria.
¿Cómo actúa la Ticlopidina?
Impide la unión del fibrinógeno a las glucoproteínas IIb y IIIa, imposibilitando la formación de agregados de plaquetas.
El mecanismo de acción es muy diferente al de la Aspirina. Ésta inhibe la síntesis de tromboxano A2 y prostaciclina como resultado de la inhibición de la enzima «prostaglandina-sintetasa». [Recuérdese que el tromboxano A2 y la prostaciclina se segregan por las células del endotelio vascular].
Ensayos clínicos.-
Los ensayos clínicos, primero en voluntarios sanos, más tarde en enfermos, se enfrentaron a un problema metodológico: la evaluación de la eficacia clínica de un antiagregante plaquetario. La demostración de una acción específica no es criterio suficiente para validar un efecto terapéutico. Ello implicaba llevar a cabo exhaustivos y costosos ensayos clínicos. Con el fin de acelerar el proceso y reducir costes, Sanofi estableció acuerdos con Daiichi Seiyaku, en Japón, y con Syntex en Estados Unidos.
Al objeto de posicionar pronto el medicamento en el mercado farmacéutico se optó por un enfoque a corto plazo, eligiendo situaciones clínicas que pudiesen aportar resultados estadísticos con un reducido número de pacientes. A tal fin se seleccionaron las dos situaciones siguientes: reducción de la agregación plaquetaria en el circuito extracorpóreo durante la hemodiálisis; e controlar la masiva agregación plaquetaria postquirúrgica en cirugía cardíaca. Estas dos indicaciones fueron las primera autorizadas para la Ticlopidina, en el año 1978. Además, con los beneficios obtenidos de la venta del fármaco en esas dos indicaciones se pudieron plantear extensos estudios clínicos de prevención tromboembólica a largo plazo.
Como con cualquier tratamiento preventivo el criterio para valorar los resultados de los ensayos clínicos no se podía establecer en base a la curación de una enfermedad. Se trataba de seguir la evolución temporal de distintos cohortes (grupos de pacientes) con un riesgo comparable de presentar un determinado acontecimiento, y determinar la probabilidad. El número de participantes en los ensayos está condicionado por la frecuencia del suceso que se quiere medir en el grupo de estudio. Por ejemplo, los pacientes que han sufrido un accidente isquémico transitorio (TIA, de su acrónimo en inglés) tienen una probabilidad del 10% de sufrir durante los 12 meses siguientes un infarto de miocardio o un ictus. Para poder demostrar en el grupo de estudio un efecto discernible de la Ticlopidina con un 90% de probabilidades es necesario llevar a cabo un seguimiento de no menos de 3.000 pacientes durante un trienio.
Sin embargo, en una etapa intermedia, se investigó y demostró la eficacia de la Ticlopidina en situaciones de alto riesgo trombótico tales como el mantenimiento de la permeabilidad de las vías de acceso venoso durante la hemodiálisis o en pacientes con cirugía de anastomosis arterial-coronaria (cirugía de by-pass).
En un estudio japonés (Murakami M., et al. Igaku no Ayumi 1983; 127: 950) la Ticlopidina se mostró superior a la Aspirina® en la incidencia combinada de accidentes trombóticos irreversibles (infarto de miocardio, ictus, mortales o no) y de recidivas de accidentes isquémicos transitorios.
Por otra parte, dos estudios, uno francés (Arcan J.C., et al. Angiology 1988; 9: 802) y otro norteamericano (Ellis D.J., Eckhoff A. Angiologie 1988 Suppl 5; 77:31) apoyados por un metaanálisis de los ensayos disponibles en el caso de arteriopatía periférica, demostró que en esta población de estudio se observaba un beneficio indiscutible en la prevención de los accidentes trombóticos sistémicos. Todos estos estudios fueron determinantes para la ampliación de las indicaciones de Ticlopidina en el año 1986.
Los ensayos clínicos, junto con la ampliación de las indicaciones autorizadas, condujeron a la notificación de algunos efectos adversos de la Ticlopidina, siendo el más notorio la neutropenia, reversible cuando se interrumpía el tratamiento.
La notificación del riesgo de neutropenia, y otros efectos adversos, hizo que se modificase la ficha técnica del medicamento; pero también que se reorientase el programa de desarrollo hacia patologías más graves al objeto de hacer aceptable la relación «beneficio vs riesgo».
Fue así como se llevaron a cabo los ensayos clínicos más importantes con la Ticlopidina: STIMS (Swedish Ticlopidine Multicenter Study), CATS (Canadian American Ticlopidine Study), TASS (Ticlopidine Aspirin Stroke Study); y TIMAD (Ticlopidine Micro-Angyopathy Diabetic).
Los cuatro ensayos nombrados en el párrafo previo demostraron de manera indubitada la eficacia de la Ticlopidina para la prevención de trombosis en personas de alto riesgo (afectados por arteriopatía en extremidades inferiores o por accidentes isquémicos cerebrales transitorios (TIA) o definitivos (ictus).
Así mismo, se demostró la eficacia de la Ticlopidina para frenar la progresión de la retinopatía diabética.
Uno de los interesantes aspectos que enseñó el desarrollo de la Ticlopidina es que la autorización escalonada (unas indicaciones primero, otras más tarde) de un nuevo medicamento es una estrategia muy útil, ética y económicamente, ya que los riesgos de efectos adversos inesperados y graves están relativamente controlados, y los beneficios obtenidos de la venta para indicaciones específicas permiten financiar los costosos y prolongados ensayos clínico requeridos para indicaciones más generales, incluidos la prevención de graves enfermedades.
Para una información más pormenorizada consulte con nosotros a través de la página web www.farmacialasfuentes.com
Bibliografía sobre la Ticlopidina:
- McTavish D., et al. Ticlopidine: an updated review of its pharmacology and therapeutic use in platelet-dependent disorders. Drugs 1990; 40: 238-59.
- Flores Runk P. Raasch RH. Ticlopidine and anti-platelet therapy. Ann Pharmacother 1993; 27: 1090-8.
- Farver DK, Hansen LA. Delayed neutropenia with Ticlopidine. Ann Pharmacother 1994; 28: 1344-6.
Antiagregantes plaquetarios comercializados en España (noviembre 2019)
- Heparina
- Ácido acetilsalicílico (a dosis bajas, de 100, 150 o 300mg)
- Abciximab
- Cilostatol
- Clopidogrel
- Dipiridamol
- Epoprostenol
- Eptifibatida
- Iloprost
- Prasugrel
- Selexipag
- Ticagrelor
- Ticlopidina
- Tirofibán
- Triflusal
Zaragoza, a 21 de noviembre de 2019
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Farmacia Las Fuentes
Florentino Ballesteros, 11-13
50002 Zaragoza