Caripracina (RGH-188) se descubrió a partir de las impurezas químicas de un conjunto de derivados piperacínicos y piperidínicos que mostraron notable afinidad por los receptores dopaminérgicos D2 y D3. Inicialmente, lo más llamativo de Caripracina fue su excelente absorción por vía oral y difusión en el tejido cerebral. Se comercializa como Reagila® en la Unión Europea donde se autorizó el 19 de mayo de 2017, tras informe favorable del CHMP (Committee for Human Medicinal Products) con la indicación del tratamiento de la esquizofrenia. La Food and Drug Administration aprobó su uso en Estados Unidos, con el nombre registrado de Vraylar®, en agosto de 2015 con dos indicaciones: tratamiento de la esquizofrenia y el control de las crisis maníacas en la enfermedad bipolar.
El laboratorio húngaro Gedeon Ritcher descubrió el fármaco en el año 2004. En noviembre de ese año, Laboratorios Forest (Estados Unidos), hoy día AbbVie tras su adquisición del laboratorio Allergan, estableció un acuerdo para su comercialización en Estados Unidos y Canadá, mientras Gedeon Ritcher mantendría sus derechos en el resto del mundo. Sin embargo, dos años más tarde (2006) Gedeon Ritcher cedió los derechos de comercialización a Mitsubishi Tanabe Pharma para su venta en Japón y el resto de Asia. Otros acuerdos se firmaron para su comercialización en países como Túnez, Argelia y Turquía.
Farmacodinamia de la Caripracina.-
Caripracina es un agonista parcial de los receptores dopaminérgicos D3 y D2 (con una afinidad por el receptor D3 un orden de magnitud superior)..
La actividad de la Caripracina in vivo depende del status funcional del sistema estudiado, actuando como antagonista en sistemas con función dopaminérgica normal, pero como agonista parcial cuando el tono dopaminérgico esta disminuido.
[Caripracina interactúa también con subtipos de receptores serotoninérgicos: 5HT1A (agonista) y 5HT2B (antagonista)].
Estudios en voluntarios sanos.-
Una dosis única (0,5mg) de Caripracina ocupó el 12% de todos los receptores D3/D2 en el núcleo estriado; mientras que esta ocupación [de los receptores] aumentó hasta un 63 a 79% tras un régimen de dosis múltiples de 1mg diario.
Estudios en pacientes con diagnóstico de esquizofrenia.-
Un régimen de tratamiento de 14 días ajustado a una posología de 3mg diarios condujo a una ocupación de los receptores D3/D2 ≥ 90% en la región estriada dorsal (núcleo caudado y putamen) y en la región estriada ventral (núcleo accumbens). La ocupación de los receptores se redujo con la pauta de administración de 1,5mg diarios (69% en los núcleos accumbens septi y caudado; y 75% en el putamen).
[Los tres (núcleos accumbens, caudado, y putamen) son agrupaciones pleiomórficas de somas neuronales pertenecientes a los ganglios basales, siendo el putamen el de mayor tamaño].
Farmacocinética y metabolismo.-
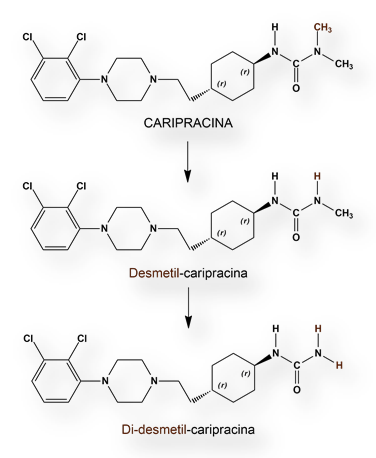 Siguiendo la administración de una única dosis de Caripracina la TMÁX se observó al cabo de entre 3 y 4 horas, en condiciones de ayuno. La toma junto con alimentos retrasa la absorción, pero no modifican la cantidad total absorbida.
Siguiendo la administración de una única dosis de Caripracina la TMÁX se observó al cabo de entre 3 y 4 horas, en condiciones de ayuno. La toma junto con alimentos retrasa la absorción, pero no modifican la cantidad total absorbida.
La Vida Plasmática Media de eliminación (T1/2β) fue de 5 a 6 días.
En un régimen de administración múltiple se produjo notable acumulación del medicamento (y sus dos metabolitos más importantes, desmetil-caripracina y di-desmetil-caripracina). La vida plasmática media de di-desmetil-caripracina fue de 2 a 3 semanas.
Las concentraciones plasmáticas de estabilización (steady-state) en un régimen de dosis múltiples se lograron al cabo de 1 semana de instaurado el tratamiento.
La cinética de Caripracina en pacientes con diagnóstico de esquizofrenia fue similar a la observada en voluntarios sanos.
Caripracina no es inductor del metabolismo hepático (estudios en sistemas aislados de microsomas hepáticos y en cultivos de hepatocitos). Por lo tanto, no se prevén interacciones farmacológicas de ese tenor. Caripracina se metaboliza en reacciones catalizadas por las isoenzimas CYP2D6 y CYP3A4, pero no inducen la actividad de estos sistemas enzimáticos. CYP es el acrónimo de Citrocromo P [450].
Indicación de la Caripracina.-
La única indicación autorizada de Caripracina en países europeos y otros de su ámbito geográfico es el tratamiento sintomático de la esquizofrenia.
Para su autorización se tuvieron en cuenta los resultados de tres ensayos clínicos fase 3. Uno de ellos involucró a 617 adultos esquizofrénicos distribuidos aleatoriamente y con «doble-ocultación» en cuatro grupos, tratados respectivamente con 3mg q.d. de Caripracina, 6mg q.d. de Caripracina, 10mg de Aripiprazol q.d., o placebo. El ensayo duró 6 semanas. Los grupos tratados con Caripracina mejoraron en la escala PANSS (Positive And Negative Syndrome Scale) en relación al grupo placebo. La mejoría significativa es evidenció al cabo de 1 semana (dosis de 6mg) y 3 semanas (dosis de 3mg). La mejoría fue también evidente al cabo de 1 semana en el grupo tratado con Aripiprazol (10mg).
De los 617 participantes del estudio, 67% completaron las seis semanas de seguimiento. Los porcentajes de abandono (casi siempre por tres efectos adversos – acatisia, insomnio y cefalea-) fueron similares en todos los grupos: 33% en el grupo tratado con 3mg/día de Caripracina, 38% en el que recibió 6mg diarios de Caripracina, 25% en el grupo de 10mg de Aripiprazol y 38% en el grupo placebo. [Curiosamente el efecto placebo localiza neuronalmente en el núcleo accumbens].
La incidencia de acatisia, insomnio y cefalea fue ≥ 10%, estimación que se ha incluido en la ficha técnica del fabricante.
En otro estudio clínico fase 3 con dosis variables (a diferencia del anterior que se realizó con dosis fijas) se distribuyeron (aleatoriamente y con «doble-ocultación») a los pacientes en tres grupos: tratados con Caripracina 3 a 6mg q.d.; Caripracina 6 a 9mg q.d.; y placebo. La duración de este estudio fue también de 6 semanas. Se utilizó así mismo la escala PANSS. Los resultados favorables se observaron al cabo de 1 semana (rango de dosis 6 a 9mg), y 2 semanas (rango de dosis 3 a 6mg). Los porcentajes de abandono fueron de 36% (grupo tratado con 3 a 6mg), 42% (grupo de 6 a 9mg); y 40% entre los incluidos en el grupo placebo.
Los efectos adversos, observados en ≥ 10% de los participantes, incluyeron acatisia, cefalea, insomnio, inquietud y otros cuadros extra-piramidales.
Tolerancia de Caripracina.-
Caripracina no tiene efectos adversos sobre los parámetros metabólicos, la secreción de prolactina, ni da lugar a la elongación del intervalo QT del electrocardiograma.
Los efectos adversos referidos en un estudio clínico fase 2 fueron los siguientes: insomnio, síndrome extra-piramidales, acatisia, sedación, náusea, vértigo y estreñimiento.
La incidencia observada de efectos adversos extra-piramidales fue mayor durante los ensayos clínicos en pacientes maníacos que en aquellos que valoraban a los pacientes con esquizofrenia.
Caripripacina en el vademécum antipsicótico.-
En la actualidad, entre los medicamentos antipsicóticos de segunda generación, considerados primera línea de tratamiento, hay varios disponibles en versiones genéricas: Risperidona, Olanzapina, Quetiapina (en formulación de liberación inmediata) y Ziprasidona. Los demás mantienen en vigor sus derechos de patente por lo que no existen, por ahora, versiones genéricas más baratas. Éstos, más recientes, alteran menos las variables metabólicas y no dan lugar ganancia ponderal Se incluyen en este grupo: Aripiprazol, Paliperidona, Iloperidona, Asenapina y Lurasidona. No son terapéuticamente intercambiables.
Todos los antipsicóticos de segunda generación comparten (excepto Amisulpiride) su afinidad por los receptores D2 y 5HT2A. Sin embargo, cada fármaco tiene una farmacodinamia distinta con un patrón diferencial de afinidad por receptores dopaminérgicos, serotoninérgicos, noradrenérgicos, histaminérgicos y muscarínicos.
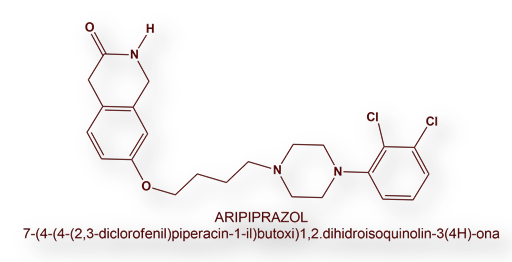 Una situación especial se presenta entre los antipsicóticos agonistas parciales del receptor D2. Hasta la aparición de Caripracina, el único antipsicótico comercializado con esta característica farmacodinámica (agonista parcial de los receptores D2) era Aripiprazol (disponible en diversas formulaciones orales y parenteral). Aripiprazol está aprobado para el control sintomático de la esquizofrenia, crisis maníacas (aisladas o en un entorno de enfermedad bipolar), adyuvante en la enfermedad depresiva mayor, y en los cuadros de irritabilidad asociados a los síndromes autistas. Otro agonista parcial más reciente es el Brexpiprazol, autorizado por la Food and Drug Administration en el año 2015 y por la Agencia Europa del Medicamento en el año 2018, con los nombre registrados de Rexulti® (Estados Unidos) y Rxulti® “sin la letra e” en la Unión Europea.
Una situación especial se presenta entre los antipsicóticos agonistas parciales del receptor D2. Hasta la aparición de Caripracina, el único antipsicótico comercializado con esta característica farmacodinámica (agonista parcial de los receptores D2) era Aripiprazol (disponible en diversas formulaciones orales y parenteral). Aripiprazol está aprobado para el control sintomático de la esquizofrenia, crisis maníacas (aisladas o en un entorno de enfermedad bipolar), adyuvante en la enfermedad depresiva mayor, y en los cuadros de irritabilidad asociados a los síndromes autistas. Otro agonista parcial más reciente es el Brexpiprazol, autorizado por la Food and Drug Administration en el año 2015 y por la Agencia Europa del Medicamento en el año 2018, con los nombre registrados de Rexulti® (Estados Unidos) y Rxulti® “sin la letra e” en la Unión Europea.
Caripracina es un agonista parcial de los receptores dopaminérgicos D2/D3, con una afinidad un orden de magnitud superior sobre el receptor D3. Se le compara con otro antipsicótico agonista dopaminérgico Aripiprazol.
El receptor dopaminérgico D3 es un auto-receptor (localizados en la membrana presináptica) que controla contribuye a regular la actividad de los receptores NMDA (N-Metil-D-Aspartato).
Por otra parte, su interacción (agonista parcial) con el receptor 5HT1A parece explicar los síntomas negativos de la esquizofrenia, como el retraimiento social.
Ejerce acción antagonista sobre el receptor 5HT2B.
En pacientes con esquizofrenia, la Vida Plasmática Media durante la fase de eliminación (fase β en un modelo cinético bicompartimental) es de 2 a 5 días cuando se prescribe en un rango de dosis de entre 1,5 y 12,5mg diarios.
Es fundamental un estudio más pormenorizado del principal metabolito de Caripracina, el di-desmetil-caripracina. Su prolongada Vida Plasmática Media (2 a 3 semanas) podría permitir una formulación oral de administración semanal que facilitase la adherencia terapéutica y sustituir a las inyecciones intramusculares depot de antipsicóticos.
Los potentes inductores de la isoenzima CYP3A4 (verbigracia Carbamacepina) o inhibidores (verbigracia Ketoconazol) pueden modificar las concentraciones plasmáticas de Caripracina.
Los efectos adversos se han descrito bajo el epígrafe previo.
Caripracina es, pues, una alternativa al Aripiprazol. Sería de interés un análisis comparativo entre ambos medicamentos.
Zaragoza, a 23 de noviembre de 2020
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Farmacia Las Fuentes
Zaragoza


