Microfotografía de un corte de tejido pancreático mostrando (marrón) tejido canceroso
El cáncer de páncreas (técnicamente: adenocarcinoma ductal) continúa siendo uno de los procesos tumorales con peor pronóstico. Con diferencias entre países, en España es tercero en términos de mortalidad, solo precedido por los de pulmón, y colon y recto. En la actualidad, tres de cada cuatro personas diagnosticadas de cáncer de páncreas fallecen antes de un año; y menos del 10% sobreviven al cabo de 5 años tras el diagnóstico.
Aproximadamente 3 de cada 100 diagnósticos de cáncer lo son de cáncer de páncreas.
La prevalencia del adenocarcinoma ductal es mucho más común a partir de la sexta década de vida. Menos del20% de los afectados tienen el adenocarcinoma localizado.
Hay factores que predisponen a su aparición, y otros que son genéticos y por lo tanto, inevitables. El hábito tabáquico (multiplica por entre 2,5 y 3,6 la probabilidad de padecerlo en relación a los no-fumadores), la obesidad, diabetes tipo 2, pancreatitis, cirrosis hepática, y colecistectomía, son factores predisponentes.
Recientemente se ha observado que las personas con grupos sanguíneos A, B y AB tienen un mayor riesgo de cáncer de páncreas en relación a los del grupo sanguíneo 0.
Entre un 5% y un 10% de los pacientes con cáncer de páncreas tienen una historia familiar de la enfermedad. La probabilidad de desarrollar un cáncer de páncreas se multiplica por un factor de 1,57 en familias con cuatro o más miembros afectados.
 El cáncer de páncreas es el resultado de la acumulación sucesiva de mutaciones genéticas. Aparece en el epitelio ductal (neoplasia epitelial), evolucionando desde lesiones pre-malignas a un tumor invasivo. La progresión desde un epitelio mínimamente displásico (neoplasia intraepitelial grado 1) a una displasia más grave (neoplasia intraepitelial grados 2 y 3) hasta un adenocarcinoma invasivo corre parejo a la acumulación de mutaciones.
El cáncer de páncreas es el resultado de la acumulación sucesiva de mutaciones genéticas. Aparece en el epitelio ductal (neoplasia epitelial), evolucionando desde lesiones pre-malignas a un tumor invasivo. La progresión desde un epitelio mínimamente displásico (neoplasia intraepitelial grado 1) a una displasia más grave (neoplasia intraepitelial grados 2 y 3) hasta un adenocarcinoma invasivo corre parejo a la acumulación de mutaciones.
Algunos condicionantes genéticos conocidos son:
- Mutaciones de los genes BRCA1 y BRCA2, ambas asociados con el cáncer de mama y el cáncer de ovario.
- Mutaciones del gen PALB2, estrechamente relacionado con los genes BRCA1 y BRCA2, asociado por lo tanto con el cáncer de mama.
- Mutaciones del gen KRAS2.
- Mutaciones del gen p16/CDKN2A, relacionado con el melanoma múltiple atípico familiar.
- Mutaciones del gen PRSS1, que se halla vinculado con la pancreatitis familiar.
- Mutaciones de los genes MLH1 o MLH2S. Las mutaciones de estos genes causan el síndrome de Lynch (cáncer de colon y recto hereditario sin poliposis).
- Mutaciones del gen STK11, también relacionado con el síndrome Peutz-Jeghers; y así mismo con el desarrollo de pólipos del tracto digestivo, y otras derivas cancerosas. [El síndrome de Peutz Jeghers es una genopatía autosómica dominante caracterizada por hamartomas gastroinestinales y pigmentaciones epidérmicas].
Claves:
BRCA: BReast CAncer.Localización cromosómica: 17q21.31
El gen BCRA1 codifica la síntesis de un factor supresor de la deriva tumoral, esto es, previene que las células crezcan y se dividan de manera rápida y disruptiva. Este gen juega un papel trascendental en la estabilidad del genoma.
PALB2 (localización cromosómica: 16p12.2) Acrónimo de: Partner And Localizer of BRCAs.
El gen PALB2 protege frente al desarrollo de cáncer de mama, excepto cuando ha experimentado una mutación. Actúa en conjunción con los genes BRCA1 y BRCA2 para estabilizar el genoma y prevenir las mutaciones tumorígenas. Una persona con una mutación del genPALB2 tiene una probabilidad de entre un 30% y un 60% de desarrollar cáncer de mama a lo largo de su vida; y transmitir a su descendencia (macho o hembra) un riesgo doble de cáncer de mama.
CDKN2A (localización cromosómica: 9p21.3). Acrónimo de: Cyclin Dependent Kinase Nuclear 2A.
El conjunto de genes CDKN2A codifica la síntesis de varias proteínas, de las que la 16p/CDKN2A es la mejor estudiada. Ésta, y otras proteínas, frenan la división celular de las células senescentes, las más proclives a sufrir una deriva tumoral a consecuencia de errores durante la mitosis.
PRSS1 (localización cromosómica: 7q.34). Acrónimo de: Serine PRoteSe 1.
Este gen codifica la síntesis de tripsinógeno en su forma catiónica, un precursor de la enzima tripsina, perteneciente a la familia de las serina-peptidasas. El tripsinógeno se segrega por las células exocrinas del páncreas, siendo hidrolizada a tripsina en el duodeno. Las mutaciones de este gen están relacionadas con pancreatitis hereditarias
MLH1, MLH2 (localización cromosómica: 3p22.2). Acrónimo de: MutL Homolog 1, MutL Homolog 2.
Este gen codifica la síntesis de una proteína que heterodimeriza con reparación discordante la endonucleasa PMS2 para formar MulTα, que se engarza a MulTβ y otras proteínas accesorias. Esta reparación discordante genera un espacio para la degradación del ADN por exonucleasas. Este gen también se ha identificado como un locus, frecuentemente mutado, en la herencia del cáncer de colon no asociado a pólipos previos.
STK11 (localización cromosómica: 19P13.3). Acrónimo de: Serine Threonine Kinase 11.
El gen STK11 (también designado LKB1) contiene las instrucciones para la síntesis de la enzima serina/treonina-quinasa-11. Esta enzima actúa como supresor tumoral (previene que las células se dividan de forma incontrolada, esto es, tumoral). Además, esta enzima es fundamental para la correcta orientación (polarización) de las células en los tejidos, regulando la cantidad de energía [metabólica] que utilizan las células. Regula la apoptosis (muerte celular programada). Esta enzima juega, así mismo, funciones trascendente en el desarrollo prenatal.
Casi todos los cánceres de páncreas son portadores de 4 o más mutaciones; afectando al gen k-ras en el 90% de los casos.
Así mismo, el 95% de los tumores tienen inactivado el gen CDKKN2A con pérdida de la proteína p16 (un factor proteico que regula el ciclo celular). La ausencia de la proteína p15 da lugar a la proliferación descontrolada (tumoral) de las células.
El gen tp53 (que codifica la proteína TP53) se halla mutado en el 50 a 75% de todos los tumores pancreáticos. Esta mutación bloquea las señales para la apoptosis celular, permitiendo que las células no mueran (apoptosis) y contribuyendo a la inestabilidad del genoma.
El gen dpc4 (que codifica la proteína DPC4) está ausente en aproximadamente el 50% de los cánceres de páncreas. Esta mutación trasunta en una señalización aberrante del receptor de membrana para el TGFβ (Transforming Growth Factor β).
Una característica importante del adenocarcinoma ductal (cáncer de páncreas) es la formación de un denso estroma formado por miofibroblastos. Estas células segregan diversos factores de crecimiento (TGFβ1, PDGF, FGF, colagenasa). Este estroma tiene una pobre vascularización, una característica del adenocarcinoma ductal. Las células del estroma expresan múltiples proteínas, tales como ciclooxigenasa, PDGFR, factor de crecimiento vascular, integrinas, SPARC, y otras proteínas. Todos estos factores proteicos se asocian con un mal pronóstico por la resistencia que otorgan a las células frente a los diversos fármacos. Sin embargo, también son dianas farmacológicas potenciales.
Claves:
TGFβ: Transforming Growth Factor β
PDGF: Platelet Derived Growth Factor
FGF: Fibroblast Growth Factor
El papel de la angiogénesis en el cáncer de páncreas es controvertido. La vascularización es pobre (como en muchos tumores sólidos); y el tratamiento con medicamentos «inhibidores de la angiogénesis» no suele ser eficaz.
Los adenocarcinomas ductales son relativamente resistentes a la quimioterapia y radioterapia.
Uno de los problemas del cáncer de páncreas es la inexistencia de una técnica de detección precoz, a la manera como una colonoscopia o una mamografía lo son para los tumores de colon y recto, y de mama respectivamente.
Otro problema es que el cáncer de páncreas en sus estadios iniciales es asintomático. Cuando debuta la sintomatología, la neoplasia frecuentemente se ha expandido y/o ha dado lugar a numerosas metástasis. Generalmente el diagnóstico es secundario al de otras patologías no relacionadas directamente. En estas circunstancias, la cirugía puede tener un valor paliativo, pero tiene un efecto limitado en términos de supervivencia.
De cada 100.000 personas con un riesgo promedio, solo 13 desarrollarán cáncer de páncreas; más de 400 sufrirán cáncer de colon y recto; y 1 de cada 8 mujeres de más de 80 años tendrán cáncer de mama.
Los dos únicos factores, no exógenos, determinantes para considerar que una persona tiene un riesgo superior a la media de la población son: antecedentes familiares (dos o más parientes de primer grado que hayan tenido la enfermedad), y desarrollar diabetes tipo 2 a partir de la quinta década de vida.
El cáncer de páncreas ha sido refractario, hasta ahora, a la detección mediante marcadores específicos, una herramienta muy valiosa en la detección de otros muchos tumores. El único marcador tumoral descrito para el cáncer de páncreas es la proteína CA19-9 (de: Carbohidrate Antigen 19-9, también denominado syalil-Lewis-A). Su principal problema es la falta de especificidad.
 Existen también aspectos topográficos que dificultan la detección de neoplasias de páncreas en fases tempranas. El páncreas es una glándula alargada (véase dibujo al inicio del artículo), de unos 15cm de longitud, con doble función, exocrina y endocrina. Dentro de su masa, existen agrupaciones de células especializadas (islotes de Langerhans), donde se sintetiza y segrega insulina (al conjunto de los islotes lo denominamos páncreas endocrino); y otras células, más inespecíficas que sintetizan y segregan al duodeno enzimas digestivas, fundamentales para el procesamiento de las moléculas nutrientes. El páncreas se sitúa detrás del estómago, acodándose en la primera curva del duodeno. Se halla debajo del hígado y próximo al bazo.
Existen también aspectos topográficos que dificultan la detección de neoplasias de páncreas en fases tempranas. El páncreas es una glándula alargada (véase dibujo al inicio del artículo), de unos 15cm de longitud, con doble función, exocrina y endocrina. Dentro de su masa, existen agrupaciones de células especializadas (islotes de Langerhans), donde se sintetiza y segrega insulina (al conjunto de los islotes lo denominamos páncreas endocrino); y otras células, más inespecíficas que sintetizan y segregan al duodeno enzimas digestivas, fundamentales para el procesamiento de las moléculas nutrientes. El páncreas se sitúa detrás del estómago, acodándose en la primera curva del duodeno. Se halla debajo del hígado y próximo al bazo.
Aproximadamente el 75% de los cánceres de páncreas se sitúan en la cabeza y cuello del órgano; 15-20% en lo que denominamos cuerpo de la glándula; y entre un 5 y un 10% en la parte distal (cola).
 La ubicación del páncreas, relativamente escondido, de la piel, hace que una pequeña tumoración pase desapercibida. Cuando aparecen una serie de signos y síntomas, el tumor pancreático suele haber progresado demasiado y, lo que es peor, dado lugar a metástasis. Cuando esto sucede, los signos y síntomas más comunes son: ictericia (sobre todo en los tumores en la cabeza del órgano, hepatomegalia (aumento de tamaño del hígado), masa palpable en el cuadrante superior derecho, caquexia, signo de Courvisoire, masa epigástrica, pérdida llamativa de peso (emaciación) y ascitis. Cuando los tumores afectan a la parte distal del páncreas (cola) la ictericia es menos evidente, o sencillamente inexistente, y lo más llamativo es el dolor y la emaciación. [Signo de Courvoisier: distensión palpable de la vesícula biliar debida a obstrucción del conducto colédoco causada por una masa tumoral].
La ubicación del páncreas, relativamente escondido, de la piel, hace que una pequeña tumoración pase desapercibida. Cuando aparecen una serie de signos y síntomas, el tumor pancreático suele haber progresado demasiado y, lo que es peor, dado lugar a metástasis. Cuando esto sucede, los signos y síntomas más comunes son: ictericia (sobre todo en los tumores en la cabeza del órgano, hepatomegalia (aumento de tamaño del hígado), masa palpable en el cuadrante superior derecho, caquexia, signo de Courvisoire, masa epigástrica, pérdida llamativa de peso (emaciación) y ascitis. Cuando los tumores afectan a la parte distal del páncreas (cola) la ictericia es menos evidente, o sencillamente inexistente, y lo más llamativo es el dolor y la emaciación. [Signo de Courvoisier: distensión palpable de la vesícula biliar debida a obstrucción del conducto colédoco causada por una masa tumoral].
En un editorial publicado en la revista JAMA (Journal of the American Medical Association), titulada Screening for Pancreatic Cancer. Is There Hope?, Anne Marie Lennon y otros cofirmantes de la universidad John Hopkins describen tres lesiones precursoras para el cáncer de páncreas: neoplasia intraepitelial pancreática (PanIN), neoplasias papilares intraductales (IPMN), y neoplasias quísticas mucinosas (MCN).
La mayoría de los cánceres de páncreas se originan como PanIN (neoplasias intraepiteliales pancreáticas). Suelen medir menos de 5mm, solo visibles bajo la ampliación de un microscopio. No son detectables mediante tomografía ni resonancia magnética nuclear.
Los otros dos tipos de lesiones (IPMN y MCN) apenas representan el 15% de todos los tumores de páncreas.
Con la tecnología actual es imposible diferenciar entre una lesión precancerosa que derivará en un adenocarcinoma ductal, y otra que no progresará. El asunto es de enorme trascendencia porque la exéresis de la lesión es una técnica compleja y relativamente peligrosa. La investigación se dirige a encontrar algún marcador tumoral que permita distinguir entre las lesiones que progresarán a un cáncer invasivo y las que no.
Un problema adicional es que los tumores pancreáticos se diseminan ya en las primeras etapas de su desarrollo. El páncreas es un órgano muy irrigado y próximo al hígado. En estas circunstancias, las metástasis son muy probables. Ello explica que menos del 10% de los pacientes tienen los cánceres localizados cuando se diagnostican.
Comienza a vislumbrarse algo de esperanza en la detección temprana del cáncer de páncreas. Un análisis de sangre puede detectar una combinación de ADN de las células malignas y posibles marcadores tumorales. Un estudio usando esta técnica llevado a cabo con 221 pacientes permitió identificar el 64% de los cánceres de páncreas en estadios iniciales; cuando se diagnosticaron, el 20% no habían dado lugar a sintomatología alguna.
La detección temprana del cáncer de páncreas incrementa la supervivencia por un factor de seis. De ahí la necesidad de hallar biomarcadores no invasivos. Organizaciones como Kenner Family Research Fund de New York incentivan tanto a la industria farmacéutica como a grupos de investigación pública para lograrlo.
Entretanto, una serie de síntomas pueden ser predictivos: rápida e injustificada pérdida de peso, dolor abdominal que irradia hacia la espalda, diabetes a partir de la quinta década de vida, ictericia, prurito intenso, cambio de sabor de bebidas alcohólicas, y heces de aspecto pálido y muy livianas (flotan).
Tratamiento del cáncer de páncreas en estadios iniciales.-
Para pacientes con tumores extirpables, la resección quirúrgica es la mejor opción de tratamiento. En función de la localización del tumor la técnica operativa incluye: pancreatoduodenoctomía (procedimiento de Whipple), pancreatectomía distal o total. Durante la cirugía se suelen extirpar entre 12 y 15 nódulos, dado que una exéresis más radical da lugar a mayor morbilidad postquirúrgica, pero no aumenta la supervivencia.
Hasta un 70% de los pacientes con cáncer de páncreas sufren obstrucción biliar.
El pronóstico del cáncer de páncreas, aun cuando se haya realizado una resección quirúrgica completa, continúa siendo muy desfavorable.
 El tratamiento con Fluorouracilo (junto a Leucovorin como «medicación de rescate») o Gemcitabina (Gemzar®) incrementan la supervivencia, como se ha evidenciado en dos estudios (European Study Group for Pancreatic Cancer Trial 1; y, Charité Onkologie 1 Trial).
El tratamiento con Fluorouracilo (junto a Leucovorin como «medicación de rescate») o Gemcitabina (Gemzar®) incrementan la supervivencia, como se ha evidenciado en dos estudios (European Study Group for Pancreatic Cancer Trial 1; y, Charité Onkologie 1 Trial).
Otro estudio (Radiation Therapy Oncology Group), mostró que la asociación de radioterapia y quimioterapia con Gemcitabina mejoraba la supervivencia en pacientes con cáncer del cuello del páncreas.
La supervivencia promedio en pacientes con cáncer de páncreas en estadios iniciales oscila entre 20 y 22 meses, desde el diagnóstico.
Tratamiento del cáncer de páncreas avanzado y/o con metástasis.-
 Cuando el cáncer pancreático está extendido o bien ha dado lugar a metástasis (sobre todo en hígado y cavidad peritoneal), casi la única opción es el tratamiento paliativo. En estas circunstancias, la supervivencia suele ser de 9 a 10 meses.
Cuando el cáncer pancreático está extendido o bien ha dado lugar a metástasis (sobre todo en hígado y cavidad peritoneal), casi la única opción es el tratamiento paliativo. En estas circunstancias, la supervivencia suele ser de 9 a 10 meses.
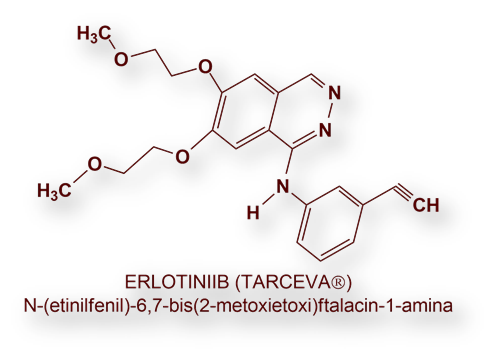
No obstante, se suele administrar Gemcitabina, sola o asociada a Erlotinib, habiéndose observado un aumento marginal de la supervivencia.
En la actualidad, la Gemcitabina se asocia, bien con Erlotinib, «derivados del platino» o una fluoropirimidina (la Gemcitabina lo es).
Tal vez la esperanza proceda de la inmunoterapia.
Hoy día, el adenocarcinoma ductal (cáncer de páncreas) continúa siendo refractario a la mayoría de las opciones terapéuticas.
Zaragoza, a 1 de octubre 2019
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Farmacia Las Fuentes
Zaragoza

